Articles scientifiques
Evaluation de l’efficacité virucide de biocides sur le SARS-CoV-2
Cécile Bouvattier1,*, Valérie Vaudé-Lauthier1, Valérie Lafontaine1, Marine Eschlimann1, Mélanie Darfeuille1, Mathieu Giraud1, Laurent Berchebru1, Jérémy Raiteux1, Audrey Marangon1, Laurent Taysse1, Françoise Raynaud1
1 Direction Générale de l’Armement – Maîtrise Nucléaire Radiologique Biologique et Chimique, Division Biologie, Vert-le-Petit, France.
* Auteur de référence.
Contact : cecile.khou@intradef.gouv.fr
Téléchargez la version pdf ici
Résumé
La transmission par l’intermédiaire de surfaces et objets contaminés (dits «fomites») du virus responsable du syndrome respiratoire aigu sévère 2 (SARS-CoV-2), à l’origine de la pandémie de Covid-19, est à ce jour soupçonnée. Pour limiter la transmission par cette voie, il est important de disposer de moyens de décontamination zonale (laboratoires, salles de soins …) et surfacique (paillasses de laboratoire, instruments de laboratoire …). C’est dans ce contexte que l’activité virucide de différentes solutions biocides a été évaluée sur des particules virales infectieuses de SARS-CoV-2 déposées sur des surfaces en inox, en présence de substances interférentes, caractérisant des conditions de « saleté » définies par la norme NF 14 675.
L’ensemble des essais réalisés a permis de montrer une activité virucide de différentes solutions sur le SARS-CoV-2 : Anioxy-Spray™, Surfa’Safe™, Septalkan™, hypochlorite de sodium (Eau de Javel) à 1 % de chlore actif (10 000 ppm), vinaigre ménager à 14° en acidité, Bactipal™ à une concentration de 2 % finale et alcool éthylique dénaturé à 62,5 % (alcool ménager). Les essais ont montré que cette activité virucide dépendait de la concentration en principe actif, du temps de contact mais également du degré de « saleté¹ » de la surface à décontaminer.
1 Le terme « niveau de saleté » est utilisé dans le texte de la norme NF EN 14 675 et correspond à des concentrations différentes de substances interférentes, la BSA et l’extrait de levure.
Le virus responsable du syndrome respiratoire aigu sévère 2 (SARS-CoV-2) est un Betacoronavirus de la famille des Coronaviridae. Il est responsable de la maladie appelée Covid-19. Les premiers cas d’infection au SARS-CoV-2 ont été rapportés en décembre 2019, dans la province de Wuhan en Chine. Depuis, le virus s’est propagé sur tous les continents, provoquant une pandémie. Comme la majorité des virus respiratoires, le SARS-CoV-2 se transmet principalement par voie aérienne, sous forme de gouttelettes. Ces gouttelettes se déposent sur des surfaces et vecteurs inertes (« fomites »). Le virus peut ensuite être transmis par contact avec ces surfaces (OMS 2020). Il est donc crucial dans la lutte contre la propagation du virus de disposer de moyens de décontamination surfacique. Ce travail s’inscrit dans cet objectif d’évaluer l’efficacité virucide sur le SARS-CoV-2 de différents biocides appliqués à la décontamination de surface.
Les laboratoires et hôpitaux utilisent le plus souvent des solutions commerciales, telles que l’Anioxy-Spray™, le Surfa’Safe™ (Laboratoires ANIOS) et le Septalkan™ (Alkapharm), pour la décontamination des objets et plans de travail selon une action volontaire, sous la forme d’une pulvérisation dirigée sur les surfaces à traiter. Toutes ces solutions sont indiquées comme étant efficaces sur les virus (Laboratoire ANIOS, n.d.; Laboratoires ANIOS, n.d.; Alkapharm, n.d.), selon les normes EN 14 476, EN 13 610 et EN 14 675.
D’autres produits chimiques plus communs, que nous pourrions appeler «grand public», peuvent aussi présenter des propriétés biocides. Citons par exemple l’éthanol (principal principe actif du gel hydro-alcoolique), efficace en milieu liquide sur les coronavirus SARS-CoV-1 (responsable de l’épidémie de 2003), MERS-CoV (coronavirus du syndrome respiratoire du Moyen-Orient) et SARS-CoV-2 (Kratzel et al. 2020 ; Kariwa et al. 2004), l’Eau de Javel, à une concentration minimale de 500 ppm en chlore (Lai et al. 2005) ou bien encore le vinaigre d’alcool, à une concentration de 6 % en acidité (Rabenau et al. 2005) efficaces en phase liquide sur le SARS-CoV-1. Enfin, des biocides utilisés dans des secteurs non médicaux ou de laboratoire peuvent aussi être utiles dans la lutte contre le SARS-CoV-2. Il s’agit par exemple du Bactipal ELV™; une solution à base d’acide peracétique (5 %), de peroxyde d’hydrogène et d’acide acétique utilisée en horticulture (homologuée par le Ministère de l’Agriculture et de l’Alimentation). Il présente une activité virucide à une concentration finale de 2 % (JohnsonDiversey, n.d.).
L’objectif du travail présenté ici n’est pas d’aboutir à une normalisation de ces produits biocides. Il s’agit pour nous de vérifier leur activité, déjà éprouvée contre d’autres micro-organismes, sur des dépôts de SARS-CoV-2 en suspension dans une matrice comportant deux niveaux d’interférents, décrits par la norme NF EN 14 675, représentatives de conditions réelles de travail ou de circonstances de la vie quotidienne (salissures ménagères par exemple).
Toutes les études avec du virus vivant ont été réalisées dans un laboratoire de niveau de sécurité biologique 3 (NSB3) selon les recommandations de la SFM (SFM avril 2020). Le matériel et méthode détaillé est présenté en annexe de ce texte. Brièvement, 10 µL d’une suspension virale à 2×106 pfu/mL, soit 2×104 pfu, ont été déposés sur des cupules stériles en inox de 9 mm de diamètre. Cette concentration est une condition majorante par rapport à des niveaux de contamination observés dans des prélèvements humains et des prélèvements de surface en milieu hospitalier (Wölfel et al. 2020, Ong et al. 2020). Les dépôts ont été séchés à température ambiante pendant 40 minutes. Cette étape de séchage engendre une chute de titre viral de 1,2 ± 0,6 log10 . A l’issue du séchage, une solution biocide a été appliquée sur la surface de la cupule.
Le tableau 1 récapitule les résultats de ces évaluations. La réduction du titre viral est calculée par rapport à la moyenne des titres viraux des contrôles non traités par le biocide, correspondant à un dépôt de 10 µL de suspension virale séché pendant 40 minutes en même temps que les dépôts des cupules traitées. Les cupules témoin ne reçoivent pas de biocide mais subissent le même temps de séchage que les cupules essais. Les conditions pour lesquelles aucune particule virale n’a pu être mise en évidence après traitement figurent dans les cases grisées.

Tableau 1 : Synthèse des résultats des évaluations de l’efficacité virucide de diverses solutions biocides. Pour chaque biocide, les temps de contact testés sont indiqués. La réduction du titre viral en log10 est exprimée par rapport à la moyenne des titres viraux des contrôles non traités par le biocide, correspondant à un dépôt de 10 µL de suspension virale séché pendant 40 minutes. Les cupules témoin ne reçoivent pas de biocide mais subissent le même temps de séchage que les cupules essais.
N.T. = non testé.
* : Le biocide est cytotoxique à une dilution de 1/10. La limite de calcul du titre viral est donc de 10 pfu/mL.
** : Le biocide est cytotoxique à des dilutions de 1/10 et 1/100. La limite de calcul du titre viral est donc de 100 pfu/mL.
L’ensemble des essais réalisés a permis de montrer que l’activité virucide des produits biocides testés, couplée à la décroissance naturelle du titre viral pendant le séchage du dépôt, permet d’éliminer l’ensemble des particules virales déposées sur les surfaces en inox.
Ces essais ont mis en évidence des différences d’efficacité virucide à l’encontre du SARS-CoV-2 pour certaines solutions, déjà démontrées efficaces sur le SARS-CoV-1. Ainsi, les essais menés sur l’Eau de Javel et le vinaigre d’alcool ont montré que les concentrations suffisantes pour inactiver le SARS-CoV-1 (Rabenau et al. 2005; Lai, Cheng, and Lim 2005) ne suffisent pas à inactiver le SARS-CoV-2. D’autre part, les temps de contact décrits dans les publications (Kariwa, Fujii, and Takashima 2004; Kratzel et al. 2020; Rabenau et al. 2005; Lai, Cheng, and Lim 2005) doivent être prolongés pour permettre l’élimination totale des particules virales de SARS-CoV-2, en particulier pour des situations où la concentration en substances interférentes est élevée. Ces différences pourraient s’expliquer par la différence de virus. En effet, les temps de demi-vie du SARS-CoV-2 et du SARS-CoV-1 sur une même surface diffèrent, ce qui suggère des propriétés physico-chimiques différentes entre les deux virus (van Doremalen et al. 2020).
Il a été montré auparavant que l’étude en phase liquide d’une solution de décontamination de surface pouvait entraîner une surestimation de l’effet biocide (Grand et al. 2011). Ainsi, il est donc possible que les différences d’effet virucide observées entre les études en phase liquide sur le SARS-CoV-1 et notre étude proviennent du fait que cette évaluation est effectuée directement sur des surfaces.
Les essais menés montrent également un effet de la matrice sur l’activité virucide. En effet, plus il y a de matière organique, moins le biocide est efficace, démontrant ainsi un effet protecteur de la matrice organique sur le virus. Cet effet a déjà été rapporté dans la littérature (Kampf et al. 2002). Il est donc important de bien prendre en compte le niveau de «saleté» avant de procéder à la décontamination des surfaces. Les protocoles de décontamination préconisés impliquent en général un prélavage des surfaces à l’aide d’un détergent puis l’application du produit biocide (Haut Conseil de la santé publique 2020). Le prélavage peut déjà permettre d’éliminer une partie des matrices organiques et d’inactiver certaines particules virales présentes sur la surface. De plus, l’action physique de frottement n’est pas prise en compte dans nos essais. Ainsi, il est tout à fait possible que nos essais sous-estiment la quantité de particules virales réellement éliminées de la surface en situation opérationnelle de décontamination.
Remerciements
Les auteurs remercient le Pr. Sylvie Van der Werf du Centre National de Référence des virus respiratoires de l’Institut Pasteur pour avoir fourni la souche de SARS-CoV-2 utilisée dans cette étude.
La SFM remercie Henri AGUT et Philippe MARIANNEAU pour leur relecture et leur contribution pour la publication de cet article.
Conflits d’intérêt
Les auteurs ne déclarent aucun conflit d’intérêt.
Financement
Les essais ont été menés dans le cadre des activités de DGA Maîtrise NRBC, sur des financements propres au centre d’essais.
Références et bibliographie
- Alkapharm. n.d. “Septalkan.” www.alkapharm.fr/fr/hygiene-medicale-cat/produit-det.php?p-236-septalkan.
- Chin, Alex W.H., Julie T.S. Chu, Mahen R.A. Perera, Kenrie P.Y. Hui, Hui-Ling Yen, Michael C.W. Chan, Malik Peiris, and Leo L.M. Poon. 2020. “Stability of SARS-CoV-2 in Different Environmental Conditions.” medRxiv.
- Corman, Victor M., Olfert Landt, Marco Kaiser, Richard Molenkamp, Adam Meijer, Daniel Kw Chu, Tobias Bleicker, et al. 2020. “Detection of 2019 Novel Coronavirus (2019-nCoV) by Real-Time RT-PCR.” Euro Surveillance : Bulletin Europeen Sur Les Maladies Transmissibles = European Communicable Disease Bulletin 25 (3). doi:10.2807/1560-7917.ES.2020.25.3.2000045.
- Doremalen, Neeltje van, Trenton Bushmaker, Dylan H. Morris, Myndi G. Holbrook, Amandine Gamble, Brandi N. Williamson, Azaibi Tamin, et al. 2020. “Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1.” The New England Journal of Medicine 382 (16): 1564–67. doi:10.1056/NEJMc2004973.
- Grand, I., M.-N. Bellon-Fontaine, J.-M. Herry, D. Hilaire, F.-X. Moriconi, and M. Naïtali. 2011. “Possible Overestimation of Surface Disinfection Efficiency by Assessment Methods Based on Liquid Sampling Procedures as Demonstrated by in Situ Quantification of Spore Viability.” Applied and Environmental Microbiology 77 (17): 6208–14. doi:10.1128/AEM.00649-11.
- Haut Conseil de la santé publique. 2020. “Avis Relatif À L’opportunité de Nettoyer et de Désinfecter, Avant Réouverture À L’issue Du Confinement, Les Établissements Recevant Du Public et Lieux de Travail Fermés Pendant La Période de Confinement, Dans Le Contexte de La Lutte Contre La Propagation Du Coronavirus SARS-CoV-2.”
- JohnsonDiversey. n.d. “Bactipal ELV.” https://www.puteaux-sa.fr/media/wysiwyg/documents/FT/Traitements/Desinfectant_et_nettoyant/13327420_0.pdf.
- Kampf, G., M. Rudolf, J.-C. Labadie, and S. P. Barrett. 2002. “Spectrum of Antimicrobial Activity and User Acceptability of the Hand Disinfectant Agent Sterillium Gel.” The Journal of Hospital Infection 52 (2): 141–47. doi:10.1053/jhin.2002.1281.
- Kariwa, H, N Fujii, and I Takashima. 2004. “Inactivation of SARS Coronavirus by Means of Povidone-Iodine, Physical Conditions, and Chemical Reagents.” The Japanese Journal of Veterinary Research, November, sec. 52(3).
- Kratzel, Annika, Daniel Todt, Philip V’kovski, Silvio Steiner, Mitra Gultom, Tran Thi Nhu Thao, Nadine Ebert, et al. 2020. “Inactivation of Severe Acute Respiratory Syndrome Coronavirus 2 by WHO-Recommended Hand Rub Formulations and Alcohols.” Emerging Infectious Diseases 26 (7): 1592–95. doi:10.3201/eid2607.200915.
- Laboratoire ANIOS. n.d. “Anioxy-Spray WS.” https:/assets.fishersci.com/TFS-Assets/CCG/EU/Laboratoires-Anios/product-Information/ANI026_FR FR ANIOXY_SPRAY_WS_2DFiche_Technique_2D00000_2DFR(1).pdf.
- Laboratoires ANIOS. n.d. “Surfa’Safe Premium.” https://www.pmd-medical.com/images/Image/File/SURFA SAFE PREMIUM_CR_MD-FF.pdf.
- Lai, Mary Y. Y., Peter K. C. Cheng, and Wilina W. L. Lim. 2005. “Survival of Severe Acute Respiratory Syndrome Coronavirus.” Clinical Infectious Diseases : An Official Publication of the Infectious Diseases Society of America 41 (7): e67-71. doi:10.1086/433186.
- NF EN 14675 – Antiseptiques et Désinfectants Chimiques – Essai Quantitatif de Suspension Pour L’évaluation de L’activité Virucide Des Antiseptiques et Des Désinfectants Chimiques Utilisés Dans Le Domaine Vétérinaire – Méthodes D’essai et Prescriptions. 2015.
- Ong, Sean Wei Xiang, Yian Kim Tan, Po Ying Chia, Tau Hong Lee, Oon Tek Ng, Michelle Su Yen Wong, and Kalisvar Marimuthu. 2020. “Air, Surface Environmental, and Personal Protective Equipment Contamination by Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) From a Symptomatic Patient.” JAMA 323 (16): 1610–12. doi:10.1001/jama.2020.3227.
- Rabenau, H. F., J. Cinatl, B. Morgenstern, G. Bauer, W. Preiser, and H. W. Doerr. 2005. “Stability and Inactivation of SARS Coronavirus.” Medical Microbiology and Immunology 194 (1–2): 1–6. doi:10.1007/s00430-004-0219-0.
- Reed, L.J., and H Muench. 1938. “A Simple Method of Estimating Fifty Per Cent Endpoints.” American Journal of Epidemiology 27 (3): 493–97.
- Siddharta, Anindya, Stephanie Pfaender, Nathalie Jane Vielle, Ronald Dijkman, Martina Friesland, Britta Becker, Jaewon Yang, et al. 2017. “Virucidal Activity of World Health Organization-Recommended Formulations Against Enveloped Viruses, Including Zika, Ebola, and Emerging Coronaviruses.” The Journal of Infectious Diseases 215 (6): 902–6. doi:10.1093/infdis/jix046.
- WHO. 2020. “Transmission of SARS-CoV-2: Implications for Infection Prevention Precaution.” July 9. https://www.who.int/news-room/commentaries/detail/transmission-of-sars-cov-2-implications-for-infection-prevention-precautions.
- Wölfel, Roman, Victor M. Corman, Wolfgang Guggemos, Michael Seilmaier, Sabine Zange, Marcel A. Müller, Daniela Niemeyer, et al. 2020. “Virological Assessment of Hospitalized Patients with COVID-2019.” Nature 581 (7809): 465–69. doi:10.1038/s41586-020-2196-x.
Annexe – Matériels et Méthodes
Virus
La souche de virus SARS-CoV-2 utilisée a été fournie par le Centre National de Référence des Virus Respiratoires de l’Institut Pasteur de Paris, dirigé par le Dr. Sylvie Van der Werf. Le virus a été produit sur cellules Vero E6, dans du milieu Dulbecco’s Modified Eagle Medium (DMEM) additionné de 2 % de sérum de veau fœtal (SVF) et d’antibiotiques et antimycotiques (ATB).
Evaluation de l’effet virucide des solutions commerciales Anioxy-Spray, Surfa’Safe et Septalkan
Dix microlitres de suspension virale à 2,2.106 pfu/mL ont été déposés sur des cupules stériles en inox d’un diamètre d’environ 9 mm (Mesa Labs). Après 40 minutes de séchage à température ambiante, 10 µL de biocide ont été déposés. Un temps de contact de 5 minutes a été opéré pour le Surfa’Safe et le Septalkan, et un temps de contact de 20 minutes pour l’Anioxy-Spray, selon les préconisations des fabricants. Pour chaque biocide évalué, trois cupules avec virus ont été traitées, une cupule avec virus constituait un témoin positif, et une cupule sans virus traitée aux biocides constituait le témoin de cytotoxicité du biocide (Fig 1).
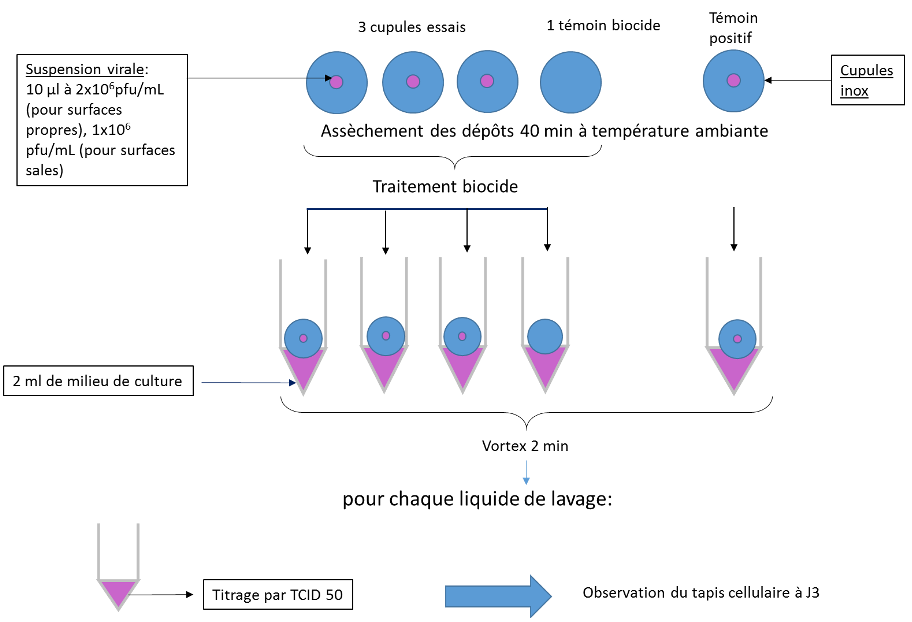
Figure 1 : Schéma des essais menés sur l’évaluation des biocides pour la décontamination surfacique
A l’issue du temps de contact, les cupules sont transférées dans des tubes Falcon contenant 2mL de milieu DMEM supplémenté de 2 % de SVF et 1X d’ATB. Les tubes sont transférés dans de la glace pour arrêter l’activité du biocide. Les suspensions sont titrées par la méthode de dilutions-limite. Les effets cytotoxiques induits par le biocide et les ECP induits par le virus sur les cellules Vero E6 ne sont pas différentiables en microscopie. Ainsi, seules les dilutions pour lesquelles aucun effet cytotoxique n’a été observé pour le témoin de cytotoxicité du biocide ont donc été considérées dans le calcul du titre viral (Fig 2). Le titre viral a été calculé selon la méthode de calcul de Reed and Muench.
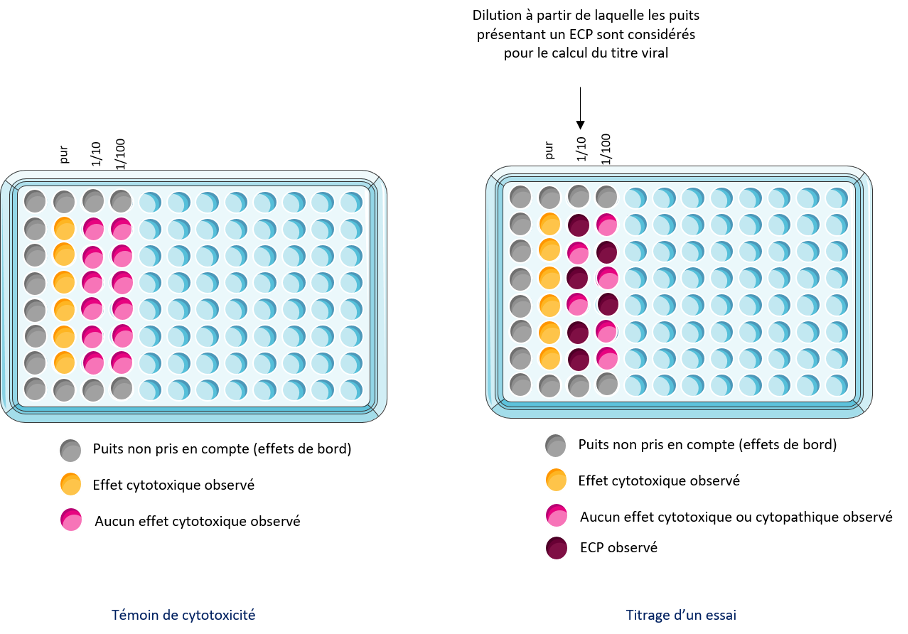
Figure 2 : Schéma de prise en compte des puits pour lesquels un effet cytopathogène est observé dans le calcul du titre viral.
Evaluation de l’effet virucide de l’eau de Javel, du vinaigre, de l’éthanol et du Bactipal
Cinquante microlitres de suspension virale à 2,2×106 pfu/mL ont été mélangés à 50µL de tampon PBS supplémenté de 0,6 % d’albumine de sérum bovin (BSA) pour les essais à faible niveau de saleté, ou 50 µL de PBS supplémenté de 1 % de BSA et 1 % d’extrait de levure pour les essais à fort niveau de saleté. Dix µL du mélange ont été déposés sur des cupules en inox. Les dépôts ont été séchés pendant 40 minutes, puis les cupules ont été traitées avec 20 µL de biocide. Les biocides testés sont :
- l’eau de Javel à 0,5 % de chlore actif,
- l’eau de Javel à 1 % de chlore actif,
- le Bactipal à 0,25 %,
- le Bactipal à 2 %,
- le vinaigre d’alcool à 8 % d’acidité,
- le vinaigre d’alcool à 14°,
- l’alcool ménager à 62,5 %.
Des temps de contact de 1 minute, 5 minutes et 60 minutes ont été opérés, conformément aux préconisations de la norme NF EN 14675, pour des essais à température ambiante (20°C). Trois cupules avec virus ont été traitées. Une cupule avec virus constituait un témoin positif, et une cupule sans virus traitée aux biocides constituait le témoin de cytotoxicité du biocide (Fig 1).
A l’issue du temps de contact, les cupules sont transférées dans des tubes Falcon contenant 2mL de milieu DMEM supplémenté de 2 % de SVF et 1X d’ATB. Les tubes sont transférés dans de la glace pour arrêter l’activité du biocide. Les suspensions sont titrées par la méthode de dilutions-limite. Les effets cytotoxiques induits par le biocide et les ECP induits par le virus sur les cellules Vero E6 ne sont pas différentiables en microscopie. Ainsi, seules les dilutions pour lesquelles aucun effet cytotoxique n’a été observé pour le témoin de cytotoxicité du biocide ont donc été considérées dans le calcul du titre viral (Fig 2). Le titre viral a été calculé selon la méthode de calcul de Reed and Muench.


