Le virus respiratoire syncytial (RSV), isolé pour la première fois en 1957, est resté longtemps considéré comme un virus pédiatrique. C’est en effet le principal agent de la bronchiolite du nourrisson, responsable chez l’enfant de moins de 5 ans de plus de 33 millions de bronchiolites, 3.3 millions d’hospitalisations et environ 120 000 décès essentiellement dans les pays en voie de développement (Shi et al., 2017). Une large étude prospective américaine a montré qu’il était responsable à lui seul de 20% des hospitalisations d’enfants de moins de 5 ans entre novembre et avril (Hall et al., 2009). Mais les réinfections par le RSV sont fréquentes tout au long de la vie. Considérées comme bénignes chez l’adulte, ces réinfections peuvent cependant se révéler sévères chez des individus âgés ou fragilisés. La prise de conscience du poids des infections par le RSV chez les sujets âgés de plus de 65 ans est récente, la première large étude prospective datant seulement de 2005. Selon cette étude, le RSV est présent chez 10% des individus de plus de 65 ans hospitalisés présentant au moins un symptôme respiratoire quelconque à l’admission, et ces patients décèdent dans environ 10% des cas (Falsey, Hennessey, Formica, Cox, & Walsh, 2005). Ces données ont depuis été confirmées par de nombreuses études. La morbi-mortalité globale des infections par le RSV chez les individus âgés approcherait ainsi celle des infections grippales saisonnières. Chez les individus souffrant d’affections respiratoires chroniques, le RSV est l’un des 3 virus les plus fréquemment retrouvés lors des décompensations avec les virus influenza A et les rhinovirus. Enfin, le pronostic des infections respiratoires basses par le RSV chez les individus profondément immunodéprimés est défavorable avec une létalité pouvant dépasser 30% dans certaines études (Shah et al., 2014). En conclusion, le poids en santé publique des infections par le RSV que ce soit chez l’enfant, les individus âgés ou les patients fragilisés est énorme. De plus, il n’existe à ce jour ni vaccin ni antiviraux commercialisés à l’exception du Palivizumab et de la ribavirine. Disponible depuis 1998, le palivizumab est un anticorps monoclonal murin humanisé administré par voie injectable aux enfants à très haut risque de bronchiolite sévère. Son rapport coût/efficacité est considéré comme médiocre bien qu’il diminue de 50% le risque d’hospitalisation chez les enfants à risque (“Palivizumab, a humanized respiratory syncytial virus monoclonal antibody, reduces hospitalization from respiratory syncytial virus infection in high-risk infants. The IMpact-RSV Study Group.” 1998). L’usage de ribavirine est exceptionnel, réservé aux infections de l’immunodéprimé profond (essentiellement, greffe de cellules souches hématopoïétiques). Le développement de vaccins et d’antiviraux ciblant de RSV apparaît ainsi comme un enjeu de santé publique aussi bien qu’un enjeu industriel important. C’est pourquoi le développement d’un vaccin contre le RSV est l’une des priorités de l’OMS. Dans ce contexte, de nombreux travaux concernant vaccins et antiviraux ont été menés, certains jusqu’à des phases 2b ou 3 avec des résultats mitigés. Les avancées récentes sur la structure de la protéine F, une des protéines de surface sur RSV, ont réorienté les stratégies de développement des vaccins sous-unitaires et des anticorps « thérapeutiques » vers de nouvelles cibles.
Le RSV est un virus enveloppé dont le génome est constitué d’un ARN simple brin de polarité négative. Son enveloppe comprend 2 glycoprotéines de surface majeures : la protéine G (pour glycoprotéine) et la protéine F (pour fusion). La protéine G est une protéine très variable hautement glycosylée qui serait impliquée dans l’attachement du virus à ses cellules cibles et dans l’échappement à la réponse immunitaire. Au contraire, la protéine F est très conservée. La conservation de la protéine F ainsi que son exposition aux anticorps neutralisants à la surface du virion ont fait de cette protéine la cible privilégiées des vaccins et des anticorps thérapeutiques développés jusqu’ici. Son rôle principal est d’assurer la fusion entre l’enveloppe virale et les membranes cellulaires mais elle pourrait intervenir aussi dans l’attachement du virus à la cellule cible (pour une revue voir (Melero, Mas, & Mclellan, 2017)). La localisation exacte du processus de fusion reste encore discutée, les derniers résultats publiés suggérant une fusion au niveau de vésicule de macropinocytose. La protéine F est une protéine de fusion de type I, à l’instar de l’hémagglutinine des virus influenza ou de la protéine G du virus de la rage. C’est une protéine transmembranaire homotrimérique, avec un large domaine extracellulaire en N terminal, un domaine transmembranaire et une courte partie intracytoplasmique. Elle est synthétisée sous la forme d’un polypeptide de 574 résidus qui subit l’addition de 5 à 6 chaînes de sucres (N-glycosylations) et un clivage en 2 sous-unités qui restent liées par un pont disulfure. La fusion membranaire est déclenchée par une transconformation majeure de la protéine F. Il existe ainsi 2 formes de cette protéine : une forme pré-fusion qui est la forme présente à la surface du virion, et une forme post-fusion qui est la forme la plus stable. Les structures de ces 2 formes sont extrêmement différentes (McLellan, Chen, Leung, et al., 2013; Swanson et al., 2011) (Figure 1). En particulier, la forme pré-fusion présente des sites antigéniques spécifiques (Flynn et al., 2016). De plus les anticorps dirigés contre certains sites de la forme pré-fusion semblent avoir un potentiel de neutralisation plus de 10 fois supérieur à celui d’épitopes communs aux 2 formes. Ces données structurales récentes ont jeté un éclairage nouveau sur les stratégies de développement de vaccins et d’anticorps thérapeutiques ciblant la protéine F.
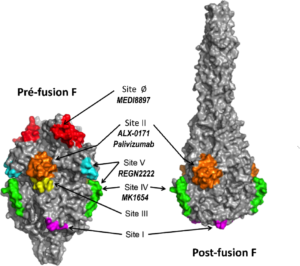
Figure 1 : Structures et sites antigéniques de la protéine F sur RSV en conformation pré- et post-fusion Représentation de la surface de la protéine F trimérique en conformation pré- et post-fusion en gris. Les sites antigéniques sont colorés et indiqués sur la figure. Les anticorps ciblant la protéine F testés chez l’être humain pour l’immunoprophylaxie des infections par le RSV sont indiqués en gras italique sous les épitopes ciblés. Figure modifiée à partir de Flynn et al, 2016 ; doi.org/10.1371/journal.pone.0164789 (Flynn et al., 2016).
Le développement de vaccins contre le RSV ou d’anticorps permettant une immunisation passive rencontre plusieurs problèmes. Tout d’abord, les résultats désastreux du premier essai réalisé dans les années 60 ont considérablement freiné les essais ultérieurs. En effet, lors de cet essai 80% des enfants qui avaient reçu le vaccin inactivé ont été hospitalisés lors de l’infection naturelle par le RSV et 2 d’entre eux (10%) sont décédés. De plus l’infection naturelle est peu protectrice, induisant au mieux une immunité transitoire (même si les bronchiolites sévères sont généralement observées lors de la primo-infection). Enfin, les corrélats de protection restent mal définis (même si la réponse cellulaire, les taux de séroneutralisation et d’IgA sécrétoires ont été corrélés à la sévérité des infections). Les premiers vaccins développés furent des vaccins vivants atténués qui, a priori, ne risquaient pas d’induire de réponse délétère chez les enfants vaccinés. Ainsi, des virus atténués par passage puis par modification génétique ciblée lors de la mise au point des méthodes de génétique inverse ont été évalués chez l’enfant. Ils n’ont pas encore permis de trouver le bon compromis entre immunogénicité et innocuité. Six d’entre eux sont aujourd’hui en phase 1 chez l’enfant. A partir des années 2000, des stratégies de vaccins sous-unitaires reposant majoritairement sur l’utilisation de la protéine F purifiée comme antigène se sont développées. Au cours des 10 dernières années, 9 candidats sous unitaires ont été testés en phase clinique. La grande majorité reposant sur l’utilisation de la protéine F comme antigène (7 sur 9). Ils sont détaillés dans le tableau 1.
Tableau 1: Récapitulatif des vaccins sous-unitaires ciblant la protéine F testés en phase clinique (10 dernières années)
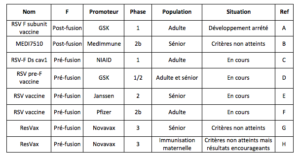
A (Leroux-Roels et al., 2019) ; B (Falloon et al., 2017) ; C (McLellan, Chen, Joyce, et al., 2013) ; D (Ott & Lippincott-Schwartz, 2012) ; E (Schwarz et al., 2019) ; F https://clinicaltrials.gov/ct2/show/NCT04032093 ; G (Fries et al., 2017) https://ir.novavax.com/news-releases/news-release-details/novavax-announces-topline-rsv-f-vaccine-data-two-clinical-trials (le 21-01-2020) ; H (August et al., 2017) http://ir.novavax.com/news-releases/news-release-details/novavax-announces-topline-results-phase-3-preparetm-trial (le 21-01-2020).
Le premier vaccin sous-unitaire de GlaxoSmithKline France (GSK) utilisait une forme post-fusion de la protéine F et n’a pas dépassé la phase 1 (Leroux-Roels et al., 2019). Le candidat vaccine MEDI-7510 a été abandonné en 2016 à la suite d’un essai de phase 2b sur 1900 adultes de plus de 60 ans (Falloon et al., 2017). Comme le précédent, il reposait sur l’administration d’une forme post-fusion de la protéine F. L’incapacité de cette F post-fusion à induire des anticorps fortement neutralisants pourrait expliquer au moins en partie cet échec. La forme pré-fusion, présente à la surface du virion et possédant des épitopes spécifiques ciblés par des anticorps neutralisants apparaît comme une alternative séduisante. Sur la base de cette hypothèse, 4 autres vaccins sous-unitaires utilisant une F stabilisée sous sa forme pré-fusion sont en développement. Le plus avancé est le candidat de Pfizer, actuellement en phase 2b chez l’adulte. Le vaccin de Novavax repose aussi sur l’administration de la protéine F mais sous forme de nanoparticules pour augmenter la réponse immunitaire. Dans ces nanoparticules, la protéine F a une conformation intermédiaire entre la forme pré-fusion et la forme post-fusion. L’essai de phase 3 sur 11 850 individus de plus de 60 ans de ce candidat n’a pas permis de prévenir les infections modérées ou sévères par le RSV. L’essai de phase 3 d’immunisation maternelle n’a pas atteint ses objectifs initiaux, mais a montré une diminution des hospitalisations et des formes les plus sévères (références tableau 1). Ces résultats sont encourageants même s’ils n’ont pas permis la mise sur le marché du vaccin.
La découverte des différences entre les structures pré et post-fusion de la protéine F ont aussi réorienté les stratégies d’immunoprophylaxie vers le ciblage d’épitopes de la forme pré-fusion. L’épitope II ciblé par le palivizumab, seul anticorps actuellement commercialisé, est commun aux formes pré et post-fusion (voir figure 1). Cet épitope est aussi la cible d’un nanobody (fragment d’anticorps monomérique de camélidé correspondant au domaine de reconnaissance de l’antigène), l’ALX-0171 destiné au traitement des infections par le RSV par voie inhalée. Les essais de phase 2 de l’ALX-0171 ont été arrêtés fin 2018 (ClinicalTrials.gov Identifier: NCT03418571), mais le développement pourrait reprendre. Le potentiel de neutralisation d’anticorps ciblant l’épitope II apparaît bien inférieur à celui d’anticorps ciblant des épitopes spécifiques de la forme pré-fusion comme l’épitope Ø. C’est pour cette raison que les anticorps destinés à l’immunoprophylaxie ayant fait l’objet d’essais cliniques ces dernières années ciblent tous des épitopes de la forme pré fusion. Ainsi le MK-1654 (Merck) cible l’épitope IV (Tang et al., 2019), le REGN2222 (suptavumab, Regeneron) cible l’épitope V et le MEDI8897 l’épitope Ø (Domachowske et al., 2018). La séquence de ces anticorps a aussi été modifiée pour en augmenter la demi-vie, permettant ainsi de réduire le nombre d’injections. Cette stratégie semble prometteuse, toutefois le développement du REGN2222 (suptavumab) a récemment été interrompu (Aout 2017 ; https://investor.regeneron.com/news-releases/news-release-details/regeneron-discontinue-development-suptavumab-respiratory/) après un essai de phase 3 non concluant qui visait la prévention des infections sévères durant les 150 premiers jours de vie (test 1177 enfants, ClinicalTrials.gov Identifier: NCT02325791).
En conclusion, malgré les obstacles à la mise au point d’un vaccin ou d’une immunoprophylaxie efficace pour les infections par les RSV, les avancées de la biologie structurale ouvrent des voies prometteuses pour le développement de stratégies de prévention. Une meilleure compréhension de la physiopathologie des infections, ainsi qu’un enrichissement des données épidémiologiques sont de plus nécessaires pour cibler au mieux les populations et les bénéfices attendus.
Marie-Anne RAMEIX-WELTI (marie-anne.rameix-welti@uvsq.fr)
Université Paris-Saclay, UVSQ, Inserm, Infection et inflammation U1173, 78180, Montigny-Le-Bretonneux, France.
AP-HP. Université Paris Saclay, Service de Microbiologie – Hygiène, Site Ambroise Paré, 9 Ave Charles de Gaulle, 92100 Boulogne-Billancourt