Un nouvel antifongique systémique ?
Chaque année dans le monde, environ 6,5 millions de personnes développent des infections fongiques invasives, et 3,8 millions en meurent. Les infections fongiques touchent les plus vulnérables, patients hospitalisés en réanimation, atteints de cancers, infectés par le VIH, transplantés d’organe solide ou greffés de cellules souches. Les genres Candida spp., Aspergillus spp. et Cryptococcus spp. demeurent les agents pathogènes les plus redoutés chez ces patients immunodéprimés et figurent en tête de la liste prioritaire des agents pathogènes fongiques de l’OMS. Bien que le « pipeline » des nouveaux antifongiques connaisse des développements exceptionnels ces dernières années, la disponibilité limitée en antifongiques (seulement quatre classes systémiques « réellement » disponibles) associée à une émergence de la résistances aux antifongiques – y compris la multirésistance – chez de nombreux filamenteux et levures représente un défi majeur pour la prise en charge des infections fongiques. Ainsi, et ce depuis de nombreuses années, la recherche et le développement de nouveaux antifongiques demeurent une priorité absolue pour les chercheurs en mycologie médicale.
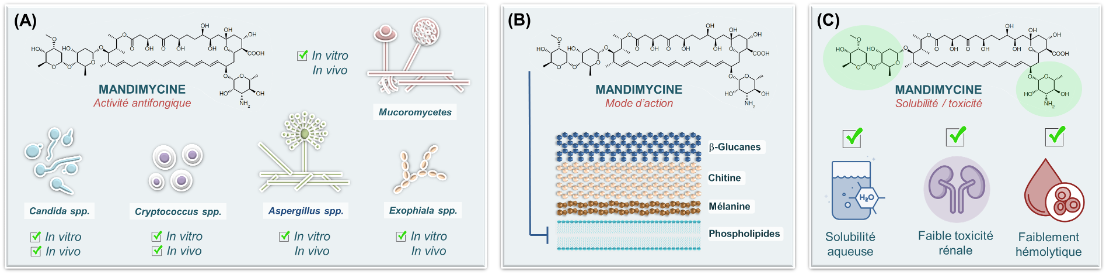
Les bactéries et les champignons produisent une vaste gamme de métabolites secondaires, à l’instar de la pénicilline, qui ont permis le développement au cours du siècle dernier de nombreux médicaments pour la santé humaine. Cependant, il existe à l’heure actuelle un très faible nombre de cibles fongiques spécifiques connues et les approches traditionnelles de recherche de molécules actives se sont essoufflées au cours des dernières années. En utilisant une approche innovante de criblage guidé par la phylogénie moléculaire, viennent de publier un magnifique article dans la revue Nature dans lequel est relatée la caractérisation d’un macrolide polyénique hautement antifongique et à large spectre : la mandimycine (Figure A).
L’analyse de l’activité antimicrobienne de ce métabolite extrait de la bactérie Streptomyces netropsis DSM 40259 s’avère extrêmement fongicide in vitro à faibles concentrations sur un large éventail de pathogènes fongiques prioritaires de l’OMS, y compris les souches multirésistantes (Figure A). Étonnamment, la mandimycine est dépourvue d’activité bactéricide, ce qui suggère que ce nouveau polyène macrolide cible des mécanismes fongiques ou des macromolécules essentiels des champignons. De plus, la mandimycine se révèle active contre les pathogènes fongiques résistants aux antifongiques polyéniques ciblant l’ergostérol (amphotéricine B et nystatine). Des recherches plus approfondies montrent que la mandimycine se complexe avec les phospholipides fongiques, en particulier le phosphatidylinositol, induisant un efflux rapide d’ions potassium et la mort des cellules fongiques (Figure B). L’absence de résistance acquise observée pour ce nouveau composé hautement actif constitue un grand espoir pour la mycologie médicale dans la mesure où l’émergence de la résistance aux antifongiques s’impose progressivement comme une problématique majeure. Enfin, à l’aide de divers modèles expérimentaux et de formulations adaptées chez la souris, Deng et ses collègues démontre l’efficacité de la mandimycine dans le traitement des candidoses superficielles et profondes ainsi que de la cryptococcose.
Un autre point remarquable est que la glycosylation de la mandimycine, avec ses trois sucres « désoxy » (une mycosamine et un didésoxysaccharide), confère une haute solubilité qui surpasse d’environ 10 000 fois celle d’une molécule antifongique de structure proche : l’amphotéricine B (Figure C). Cette solubilité élevée représente bien entendu un avantage significatif, car les spécialités polyéniques sont d’une manière générale bien connues pour leur faible solubilité aqueuse, ce qui rend leur formulation difficile et complique leur administration parentérale aux patients. Outre cette solubilité aqueuse exceptionnelle, des expériences in vitro et in vivo montre une néphrotoxicité significativement plus faible de la mandimycine par rapport à l’amphotéricine B, une absence d’effets hémolytiques et des paramètres pharmacocinétiques favorables.
Dans son ensemble, ce remarquable article met ainsi en lumière un nouvel antifongique puissant, la mandimycine, qui présente de nombreux atouts comparés aux drogues actuellement disponibles. En ciblant des phospholipides fongiques spécifiques, le mode d’action unique de la mandimycine devrait rendre extrêmement difficile le développement de mécanismes de résistance par la cellule fongique. En effet, la biosynthèse des phospholipides implique des voies métaboliques multiples et étroitement interconnectées, ce qui rend la sélection d’une combinaison complexe de mutations dans le métabolisme central un événement génétique improbable et par ailleurs certainement létal pour la cellule fongique. L’activité de la mandimycine contre un large spectre de champignons pathogènes multirésistants laisse ainsi présager de son futur développement en clinique. Affaire à suivre…!
Pour la section mycologie : Arnaud Fekkar, Vincent Courdavault, Vishnu Chaturvedi, Nicolas Papon