MODULATION DU MICROBIOTE INTESTINAL : VERS UNE MEDECINE PERSONNALISEE
(Mise à jour le 28 octobre 2020, en rouge)
Le microbiote intestinal (MI) humain représente un écosystème dense, complexe, dynamique et versatile. Les nombreuses études publiées ces dernières années ont clairement montré qu’il n’avait pas juste un rôle dans la digestion des aliments et que son impact sur la santé et le bien-être de son hôte était essentiel. Ce microbiote est constitué de milliards de microorganismes (bactéries, archées, virus et champignons) interagissant en continu entre eux, avec leur hôte mais aussi avec l’environnement.1,2 Par le biais de ces interactions, le MI exerce de nombreuses fonctions physiologiques (métaboliques, immunitaires, barrières …) à la fois au sein du tractus digestif mais également à distance de celui-ci. Par exemple, l’implication du MI dans la modulation du développement cérébral et dans la production de phénotypes comportementaux, initialement décrite dans la passionnante étude de Bercik et al. (2011)3, se retrouve actuellement sous les projecteurs dans le cadre de ce que l’on appelle “l’axe intestin-cerveau”. Les microorganismes du MI participent activement à cet axe d’interactions bidirectionnelles entre le système nerveux central (SNC) et l’intestin, par le biais de métabolites bactériens. Par exemple, le GABA ou la sérotonine produits par les bactéries du MI agissent sur le SNC directement après passage sanguin ou indirectement en stimulant les cellules entéro-endocrines ou les neurones intestinaux (~108 neurones tapissant la paroi intestinale).4,5 Ces nouvelles connaissances résonnent-elles in fine avec un concept chinois vieux de 5000 ans selon lequel notre ventre serait notre deuxième cerveau (Figure 1) ?

L’équilibre et la composition du MI vont être impactés tout au long de notre vie par divers facteurs intrinsèques (âge, infections, hormones …) ou environnementaux (alimentation, antibiotiques …).1,6 Or cet équilibre est indispensable aux nombreuses fonctions qu’il exerce, et sa perturbation, également appelée dysbiose, est de plus en plus décrite en association au développement ou à l’aggravation de certaines pathologies. Les données les plus évidentes concernent les maladies inflammatoires chroniques de l’intestin, l’obésité ou le cancer colorectal.2,7 De plus en plus d’études suggèrent également une implication du microbiote dans des pathologies d’ordre psychiatrique, en lien notamment avec le stress de l’hôte qui pourrait, via la libération dans le milieu intestinal de catécholamines et/ou de glucocorticoïdes, moduler directement (récepteurs adrénergiques bactériens) ou indirectement (modulation immunitaire, variation de pH …) les communautés bactériennes.5,8 Enfin, il a également été montré que le MI pouvait impacter la réponse à certaines thérapeutiques, comme cela a été montré pour les anticancéreux par les équipes de Laurence Zitvogel (Institut Gustave Roussy) et de François Ghiringhelli (INSERM – UMR123, Dijon).9
Bien que les mécanismes sous-jacents restent pour la plupart terra incognita, nous observons un engouement de la communauté scientifique pour les différentes voies de modulation du MI qui pourraient être proposées soit de façon préventive, soit comme option thérapeutique visant à rétablir l’équilibre intestinal, luttant ainsi contre les pathologies associées à une dysbiose (Figure 2).
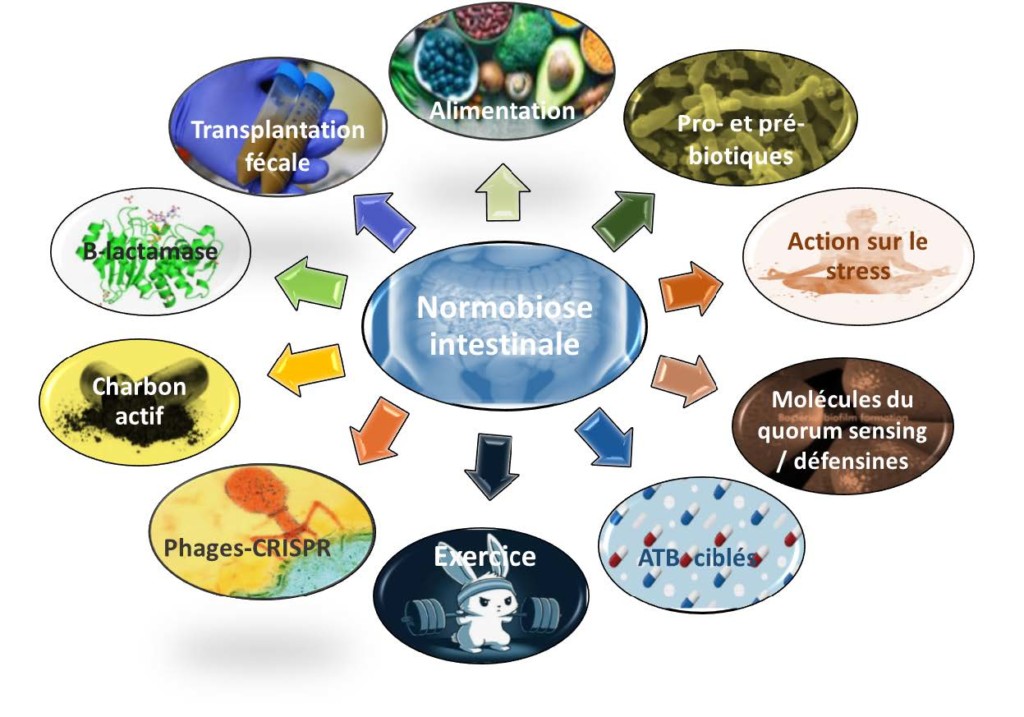
Je suis ce que je mange : alimentation et homéostasie intestinale
L’alimentation, et plus particulièrement la diversité alimentaire, sont des éléments clé de la composition et de la stabilité du microbiote intestinal.10 Dès la naissance, le mode d’alimentation (allaitement vs. lait maternisé) va influencer l’implantation et la maturation du MI du nouveau-né. 1 Les grands types de régime alimentaire (riche en protéines, en fibres ou en lipides polyinsaturés) ont par ailleurs permis de stratifier des individus sains en fonction des microorganismes prédominants dans leur MI (Bacteroides, Prevotella ou Firmicutes), définissant ainsi des entérotypes.12-14 Cependant, cette stratification ne représente que le paysage global du MI et des modifications d’alimentation entraînent rapidement des variations fines de l’écosystème intestinal.6,15,16 Il semble ainsi intéressant de jouer sur l’alimentation de telle sorte à favoriser le développement et l’implantation de bactéries bénéfiques pour le système digestif. L’étude randomisée PREDIMEDA a en effet montré qu’un régime méditerranéenB réduisait de 30% le risque relatif d’accidents cardiovasculaires par le biais d’une modification du MI au profit d’une flore produisant plus d’acides gras à chaîne courte (AGCC)C .17 Il est également possible de moduler le MI à l’aide de compléments alimentaires tels que des prébiotiques utiles à la croissance ou l’activité de certaines populations bactériennes intestinales et dont nous reparlerons dans le chapitre suivant. Une autre voie, encore peu explorée, serait d’utiliser l’alimentation pour moduler l’environnement intestinal afin de favoriser ou inhiber certains taxons bactériens. Par exemple, une alimentation riche en lipides va augmenter la sécrétion de bile, orientant la flore vers des espèces résistantes à son action détergente telles que les Clostridia ou les Enterobacteriaceae.18 Il faut cependant noter que les modifications décrites dans la plupart des approches semblent temporaires, réversibles et plutôt difficile à maîtriser.15,18 Des études ont montré que la réponse de chaque individu à un type d’aliment variait, même chez des jumeaux homozygotes, et que l’on ne pouvait donc pas s’appuyer sur des recommandations nutritionnelles standard du type « 5 fruits et légumes par jour ».10,19 Il est donc possible d’envisager dans le futur une approche diététique personnalisée prenant en compte les interconnexions entre notre MI et le type d’aliments qui nous seraient bénéfiques. L’équipe d’Eran Elinav du Weizmann Institute en Israël a ainsi réussi à améliorer le contrôle de la glycémie de patients diabétiques par le biais de recommandations nutritionnelles individualisées basées sur l’analyse des interrelations entre l’alimentation, le taux sanguin de glucose et la composition du MI.16,20
Les p~biotiques (pro-, pré-, syn-, post- et parabiotiques) au service de notre MI
La seconde voie largement étudiée est celle de l’apport direct de bactéries bénéfiques (probiotiques) et/ou de substrats favorisant leur implantation (prébiotiques, synbiotiques), voire de biomolécules qui leur sont dérivées (post- et parabiotiques).
Les probiotiques sont définis en tant que microorganismes vivants qui, ingérés en quantité suffisante, exercent des effets bénéfiques à la santé de leur hôte.21 Les plus utilisés sont la levure Saccharomyces boulardii, certaines souches de Lactobacillus ou de Bifidobacterium ou la souche Escherichia coli Nissle 1917.4,22 Les principaux mécanismes expliquant leurs effets sont liés à des phénomènes 1) de nutrition (activité glycolytique menant à la production d’AGCC, principale source d’énergie des colonocytes), 2) de compétition (occupation des niches, utilisation des nutriments, production de peptides antimicrobiens) et 3) de renforcement de l’épithélium (modulation de l’immunité locale, stimulation de la production de mucus, préservation de l’intégrité de la barrière).22,23 Les prébiotiques sont quant à eux des oligo- ou polysaccharides alimentaires non digestiblesD qui stimulent de manière sélective la croissance, l’implantation ou l’activité de microorganismes bénéfiques dans le MI.11,24 Lorsqu’ils sont administrés simultanément à des probiotiques, on parle de synbiotiques. Enfin, l’amélioration des connaissances sur les mécanismes d’action des souches probiotiques a mené à l’émergence de nouveaux concepts s’éloignant de la notion de microorganismes vivants. Les postbiotiques correspondent aux métabolites sécrétés par les probiotiques et responsables de leurs effets bénéfiques tels que des AGCC, des vitamines, des peptides, des enzymes, …25 Le terme de parabiotiques fait référence aux probiotiques inactivés soit sous leur forme intacte, soit certaines fractions cellulaires (peptidoglycane, protéines de surfaces, extraits membranaires …).25
Le marché des p~biotiques étant colossal, un nombre impressionnant d’études portent sur l’évaluation de leur impact sur la composition du MI dans divers types de pathologies, présentant souvent des conclusions contradictoires, laissant les prescripteurs dans le doute. 11,22,26-28 Les seules indications faisant à l’heure actuelle l’objet de recommandations basées sur des essais randomisés +/- méta-analyses par des sociétés savantes sont les suivantes :
- Diarrhées infectieuses Lactobacillus rhamnosus GG et S. boulardii CNCM I-745 sont efficaces dans :
- la prévention des diarrhées associées aux antibiotiques chez l’enfant (recommandations ESPGHANE et GFHGNPF)
- le traitement de la gastroentérite aiguë de l’enfant en complément de la ré-hydratation (recommandations ESPGHANG)
- la prévention des diarrhées à Clostridioides difficile (recommandations Cochrane)26
- Syndrome de l’intestin irritable (SII) amélioration de la symptomatologie par :
- la formulation De SimoneH, les souches Bifidobacterium lactis DN-173010 et Bifidobacterium infantis 35624 (recommandations mondiales WGOI)
- seulement B. infantis 35624 (recommandations nationales SNFGEJ)
- Maladies inflammatoires chroniques de l’intestin (MICI) recommandations européennes de l’ECCOK :
- la formulation De Simone est efficace dans la prévention de la pochite et dans le maintien de la rémission de la pochite et de la rectocolite hémorragique (RCH)
- la souche Nissle 1917 présente la même efficacité que le mesalazine dans l’induction et le maintien de la rémission de la RCH
- aucune preuve de l’efficacité des p~biotiques dans la maladie de Crohn (MC)
De nombreuses autres souches candidates ont également été évaluées et semblent posséder des propriétés très intéressantes, mais l’hétérogénéité des résultats obtenus, avec parfois une contradiction totale, s’oppose pour l’instant à un consensus. Comment peut-on expliquer de telles discordances ? Cela pourrait provenir d’une part de la grande variabilité méthodologique : 1) microorganisme(s) utilisé(s) (bactérie ou levure, effet souche-dépendant très important, une espèce ou un consortium), 2) posologie et schéma d’administration (avant, après ou en même temps qu’une antibiothérapie), 3) profil des patients (nutrition parentérale, pathologie sous-jacente, traitements concomitants). D’autre part, l’état du MI du patient recevant les probiotiques pourrait également expliquer ces différences car il semblerait y avoir des individus dont le microbiote est permissif à l’implantation des probiotiques alors que d’autres possèderaient un microbiote résistant.29 Il en est de même pour l’action des prébiotiques dont l’effet bénéfique disparaît en l’absence de certains taxons bactériens spécialistes dans le MI.30
L’utilisation des synbiotiques semble une bonne alternative pour donner plus de chances aux probiotiques de coloniser l’intestin de l’individu qui les reçoit. Il a par exemple été montré dans une étude clinique réalisée en Inde rurale sur plus de 4500 nouveau-nés non prématurés, que l’administration simultanée de Lactobacillus plantarum et de FOSD pendant une semaine réduisait significativement la morbi-mortalité infectieuse jusqu’à 2 mois de vie.31 Sans mettre de côté les probiotiques traditionnels, les pistes de recherche s’orientent actuellement plutôt vers des espèces bactériennes provenant du MI plutôt que de l’alimentation, seules ou sous forme de consortia, possédant à la fois des activités métaboliques et immunomodulatrices. Plusieurs taxons ont déjà démontré leur intérêt en tant que probiotiques de nouvelle génération dont les principaux sont Faecalibacterium prausnitzii, Akkermansia muciniphila, Parabacteroides distasonis, plusieurs espèces de Bacteroides ou de Blautia.32-35
La transplantation de matière fécale : le retour de la soupe jaune
Alors qu’elle est connue et pratiquée en médecine traditionnelle chinoise depuis des centaines d’années, la transplantation de microbiote fécal (TMF) n’a fait son entrée dans nos pratiques cliniques que récemment.36 Elle est basée sur l’introduction des selles d’un donneur sain dans le tube digestif d’un patient receveur afin de rééquilibrer sa flore intestinale altérée. Elle permet donc de se départir du choix d’une ou plusieurs souches bénéfiques. Bien qu’au premier abord peu ragoutante, cette approche a démontré une remarquable efficacité dans le traitement des formes récidivantes d’infection à C. difficile (ICDr) avec un taux de guérison de 80 à 90%.36-39 C’est à l’heure actuelle la seule indication de la TMF règlementée, à la fois au niveau nationalL et international : traitement de l’ICDr à partir de la 3ème récidive. Cette indication pourrait évoluer suite à l’étude monocentrique randomisée de Hvas et al. (2019)40 démontrant la supériorité de la TMF sur la fidaxomicine et la vancomycine, antibiotiques indiqués en 1ère ligne pour le traitement de l’ICD.
De telles performances ont créé un rapide engouement vers les diverses applications envisageables de la TMF, engouement renforcé par une standardisation des pratiques, des simplifications méthodologiques (capsules), et des résultats positifs obtenus chez l’animal.37-39,41,42 De nombreux essais cliniques sont actuellement en cours dans des pathologies très variées telles que le SII, les troubles du spectre autistique, la maladie de Parkinson, la dépression, le portage de bactéries multirésistantes …38,42 Des résultats encourageants ont été obtenus par plusieurs équipes pour contrer la dysbiose des patients allogreffés de cellules souches hématopoïétiques présentant une GVHM digestive.43,44 En restaurant la diversité du MI, la TMF a ainsi permis d’obtenir une réponse clinique totale en 1 mois, sans autre intervention sur la GVH, chez 10 des 15 patients testés.43 Par ailleurs, bien que les résultats observés dans les MICI restent hétérogènes45, l’étude pilote, randomisée contrôlée, menée par Harry Sokol chez des patients atteints de MC, retrouve un taux plus important de rémission sans corticoïdes ainsi qu’une amélioration de l’inflammation dans le groupe TMF, malgré l’absence d’implantation du MI donneur.46 Ces résultats très prometteurs doivent être confirmés par des études de plus grande ampleur, et des résultats positifs à court terme ne doivent pas faire oublier les récentes découvertes quant aux nombreux rôles du MI en santé et pathologie ! En effet, même si la sécurité infectieuse du greffon fécal est bien explorée lors de la sélection du donneur, quand est-il des risques métaboliques ou cancérigènes que pourraient faire courir au receveur, à moyen ou long terme, la transplantation d’un contenu bactérien non caractérisé ? Il est donc indispensable de ne pas brûler les étapes et de s’appuyer sur un cadre scientifique documenté, standardisé et sécurisé, à nouveau dans le cadre d’une approche strictement personnalisée.
Autres approches de modulation du microbiote intestinal
Parmi les autres approches visant à moduler le MI, la pratique régulière du sport semble influencer l’écosystème intestinal. Ces modifications sont probablement le reflet d’un mode de vie « sain » en lien avec une alimentation plus équilibrée et moins de surpoids. Cependant des arguments en faveur d’un effet indépendant de l’exercice physique sur le MI ont aussi été démontrés. Par exemple, le MI de marathoniens contient plus de Veillonella spp. or l’administration de ce taxon à des souris améliore leur endurance en transformant le lactacte induit par l’exercice en propionate.47
Il a parfois été envisagé d’utiliser des antibiotiques ciblant des pathobiontes impliqués dans la physiopathologie de certaines maladies en se basant sur des observations comme par exemple l’amélioration de symptômes dépressifs ou psychiatriques sous antibiotiques.3,7 Cependant, une telle approche doit être envisagée avec beaucoup de prudence eu égard d’une part à la pression de sélection risquant d’entraîner l’émergence de bactéries multirésistantes et d’autre part à l’impact de l’antibiotique sur le MI pouvant induire une nouvelle dysbiose, voire de nouvelles pathologies associées.
Des approches de protection du MI contre la dysbiose induite par les antibiotiques sont également proposées sous la forme d’administration de β-lactamases ou de charbon activé dont la formulation leur permettrait de détruire ou d’adsorber spécifiquement les reliquats d’antibiotiques dans l’intestin.48,49
Afin de détruire spécifiquement des pathobiontes ou des bactéries multirésistantes au sein du MI, certaines équipes ont utilisé des bactériophages ou des souches de probiotiques génétiquement modifiées pour produire des molécules du qorum-sensing, des peptides antimicrobiens ou des systèmes CRISPR-Cas.50-53
Enfin, étant donné qu’un stress, même modéré, peut entraîner une dysbiose, il est aussi possible d’envisager l’utilisation des moyens actuels de lutte contre l’anxiété, pharmacologiques ou psychologiques, ainsi que l’utilisation de p~biotiques.54,55
En conclusion, le MI est donc en train de se positionner en tant que nouvelle cible thérapeutique dans la prise en charge personnalisée de différentes pathologies chroniques via des stratégies variées visant à restaurer son équilibre. Cependant, la manipulation d’un écosystème aussi complexe n’est pas sans risque. Il y a donc besoin de continuer l’exploration des mécanismes fondamentaux des interactions hôte/microbiote et de valider les observations par des études cliniques standardisées. Ces données, associées au développement d’outils de monitoring de la composition du MI applicables en routine, permettront de proposer des stratégies de modulation préventive ou curative adaptées à chaque patient.
Corentine Alauzet
EA 7300 Stress Immunité Pathogènes – Université de Lorraine
Service de Microbiologie – CHRU de Nancy
c.alauzet@chru-nancy.fr
Bibliographie :
-
Landman C, Quévrain E. Le microbiote intestinal: description, rôle et implications physiopathologiques. Rev Med Interne 2016;37:418–23.
-
Matijašić M, Meštrović T, Paljetak HČ, Perić M, Barešić A, Verbanac D. Gut Microbiota beyond Bacteria-Mycobiome, Virome, Archaeome, and Eukaryotic Parasites in IBD. Int J Mol Sci. 2020;21(8):2668.
-
Bercik P, Denou E, Collins J, Jackson W, Lu J, Jury J et al. The intestinal microbiota affects central levels of brain-derived neurotropic factor and behavior in mice. Gastroenterology. 2011;141(2):599-609.
-
Kelly JR, Kennedy PJ, Cryan JF, Dinan TG, Clarke G, Hyland NP. Breaking down the barriers: the gut microbiome, intestinal permeability and stress-related psychiatric disorders. Front Cell Neurosci 2015;9:392.
-
Silva YP, Bernardi A, Frozza RL. The Role of Short-Chain Fatty Acids From Gut Microbiota in Gut-Brain Communication. Front Endocrinol (Lausanne). 2020;11:25.
-
Doré J, Multon M-C, Béhier J-M. The human gut microbiome as source of innovation for health: Which physiological and therapeutic outcomes could we expect? Therapies. 2017;72(1):1-19.
-
Alauzet C. Microbiote intestinal, dysbiose et pathologies. Correspondances en Onco-Hématologie. 2017;13(3):119-124.
-
Alauzet C, Cunat L, Wack M, Lozniewski A, Busby H, Agrinier N et al. Hypergravity disrupts murine intestinal microbiota. Sci Rep. 2019;9(1):9410.
-
Viaud S, Saccheri F, Mignot G, Yamazaki T, Daillère R, Hannani D et al. The intestinal microbiota modulates the anticancer immune effects of cyclophosphamide. Science. 2013;342(6161):971-6.
-
Johnson AJ, Vangay P, Al-Ghalith GA, Hillmann BM, Ward TL, Shields-Cutler RR et al. Daily Sampling Reveals Personalized Diet-Microbiome Associations in Humans. Cell Host Microbe. 2019;25(6):789-802.e5.
-
Moszak M, Szulińska M, Bogdański P. You Are What You Eat-The Relationship between Diet, Microbiota, and Metabolic Disorders-A Review. Nutrients. 2020;12(4):1096.
-
Arumugam M, Raes J, Pelletier E, Le Paslier D, Yamada T, Mende DR et al. Enterotypes of the human gut microbiome.Nature. 2011 473(7346):174-80.
-
Wu GD, Chen J, Hoffmann C, Bittinger K, Chen YY, Keilbaugh SAet al. Linking long-term dietary patterns with gut microbial enterotypes. Science. 2011 334(6052):105-8.
-
Costea PI, Hildebrand F, Arumugam M, Bäckhed F, Blaser MJ, Bushman FD et al. Enterotypes in the landscape of gut microbial community composition. Nat Microbiol. 2018 3(1):8-16.
-
Leeming ER, Johnson AJ, Spector TD, Le Roy CI. Effect of Diet on the Gut Microbiota: Rethinking Intervention Duration. Nutrients. 2019;11(12):2862.
-
Leshem A, Segal E, Elinav E. The Gut Microbiome and Individual-Specific Responses to Diet. mSystems. 2020;5(5):e00665-20.
-
Estruch R, Ros E, Salas-Salvadó J, Covas MI, Corella D, Arós F et al. Primary Prevention of Cardiovascular Disease with a Mediterranean Diet Supplemented with Extra-Virgin Olive Oil or Nuts. N Engl J Med 2018; 378:e34.
-
Moles L, Otaegui D. The Impact of Diet on Microbiota Evolution and Human Health. Is Diet an Adequate Tool for Microbiota Modulation? Nutrients. 2020;12(6):1654.
-
Bowyer RCE, Jackson MA, Pallister T, Skinner J, Spector TD, Welch AA, Steves CJ. Use of dietary indices to control for diet in human gut microbiota studies. Microbiome. 2018;6(1):77.
-
Zeevi D, Korem T, Zmora N, Israeli D, Rothschild D, Weinberger A, et al. Personalized nutrition by prediction of glycemic responses. Cell 2015;163(5):1079-94
-
FAO/WHO (Food and Agricultural Organization of the United Nations and World Health Organization). Guidelines for the Evaluation of Probiotics in Food. Joint FAO/WHO Working Group Report on Drafting Guidelines for the Evaluation of Probiotics in Food. London Ontario (CA); 30 April and 1 May 2002. https://www.who.int/foodsafety/fs_management/en/probiotic_guidelines.pdf
-
Mekonnen SA, Merenstein D, Fraser CM, Marco ML. Molecular mechanisms of probiotic prevention of antibiotic-associated diarrhea. Curr Opin Biotechnol. 2020;61:226-234.
-
Butel M-J. Les probiotiques et leur place en médecine humaine. Journal des Anti-infectieux. 2014;16(2):33-43,
-
Gibson GR, Hutkins R, Sanders ME, Prescott SL, Reimer RA, Salminen SJ et al. Expert consensus document: The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat Rev Gastroenterol Hepatol. 2017;14(8):491-502.
-
Nataraj BH, Ali SA, Behare PV, Yadav H. Postbiotics-parabiotics: the new horizons in microbial biotherapy and functional foods. Microb Cell Fact. 2020;19(1):168.
-
Goldenberg JZ, Yap C, Lytvyn L, Lo CKF, Beardsley J, Mertz D, Johnston BC. Probiotics for the prevention of Clostridium difficile‐associated diarrhea in adults and children. Cochrane Database of Systematic Reviews 2017;12:CD006095.
-
Guo Q, Goldenberg JZ, Humphrey C, El Dib R, Johnston BC. Probiotics for the prevention of pediatric antibiotic-associated diarrhea. Cochrane Database of Systematic Reviews 2019;4:CD004827
-
Hori T, Matsuda K, Oishi K. Probiotics: A Dietary Factor to Modulate the Gut Microbiome, Host Immune System, and Gut-Brain Interaction. Microorganisms. 2020;8(9):E1401.
-
Zmora N, Zilberman-Schapira G, Suez J, Mor U, Dori-Bachash M, Bashiardes S et al. Personalized Gut Mucosal Colonization Resistance to Empiric Probiotics Is Associated with Unique Host and Microbiome Features. Cell. 2018;174(6):1388-1405.e21.
-
Chung WS, Walker AW, Louis P, Parkhill J, Vermeiren J, Bosscher D et al. Modulation of the human gut microbiota by dietary fibres occurs at the species level. BMC Biol 2016;14:3
-
Panigrahi P, Parida S, Nanda NC, Satpathy R, Pradhan L, Chandel DS et al. A randomized synbiotic trial to prevent sepsis among infants in rural India. Nature 548, 407–412 (2017).
-
O’Toole PW, Marchesi JR, Hill C. Next-generation probiotics: the spectrum from probiotics to live biotherapeutics. Nat Microbiol. 2017;2:17057.
-
Martín R, Miquel S, Benevides L, Bridonneau C, Robert V, Hudault S et al. Functional Characterization of Novel Faecalibacterium prausnitzii Strains Isolated from Healthy Volunteers: A Step Forward in the Use of F. prausnitzii as a Next-Generation Probiotic. Front Microbiol. 2017;8:1226.
-
Hiippala K, Kainulainen V, Suutarinen M, Heini T, Bowers JR, Jasso-Selles D et al. Isolation of Anti-Inflammatory and Epithelium Reinforcing Bacteroides and Parabacteroides Spp. from A Healthy Fecal Donor. Nutrients. 2020;12(4):935.
-
Bircher L, Geirnaert A, Hammes F, Lacroix C, Schwab C. Effect of cryopreservation and lyophilization on viability and growth of strict anaerobic human gut microbes. Microb Biotechnol. 2018;11(4):721-733. doi:10.1111/1751-7915.13265
-
Mosca A. La transplantation de microbiote fécal. La Revue des Microbiotes. 2019;13:4-11.
-
Cammarota G, Ianiro G, Tilg H, Rajilić-Stojanović M, Kump P, Satokari R et al. European consensus conference on faecal microbiota transplantation in clinical practice. Gut. 2017;66(4):569-580.
-
Quigley EMM, Gajula P. Recent advances in modulating the microbiome. F1000Res. 2020;9:F1000 Faculty Rev-46.
-
Trang C, Scanzi J, Galperine T, Mosca A, Batista R, Sokol H. Transplantation de microbiote fécal dans le cadre des infections à Clostridium difficile récidivantes : actualisation des recommandations pour la pratique clinique courante. Hépato-Gastro & Oncologie Digestive. 2017;24(4):319-325.
-
Hvas CL, Dahl Jørgensen SM, Jørgensen SP, Storgaard M, Lemming L, Hansen MM et al. Fecal Microbiota Transplantation Is Superior to Fidaxomicin for Treatment of Recurrent Clostridium difficile Infection. Gastroenterology. 2019;156(5):1324-1332.e3.
-
Cammarota G, Ianiro G, Kelly CR, Mullish BH, Allegretti JR, Kassam Z et al. International consensus conference on stool banking for faecal microbiota transplantation in clinical practice. Gut. 2019;68(12):2111-2121.
-
Gupta A, Saha S, Khanna S. Therapies to modulate gut microbiota: Past, present and future. World J Gastroenterol. 2020;26(8):777-788.
-
van Lier YF, Davids M, Haverkate NJE, de Groot PF, Donker ML, Meijer E et al. Donor fecal microbiota transplantation ameliorates intestinal graft-versus-host disease in allogeneic hematopoietic cell transplant recipients. Sci Transl Med. 2020;12(556):eaaz8926.
-
Zama D, Bossù G, Leardini D, Muratore E, Biagi E, Prete A et al. Insights into the role of intestinal microbiota in hematopoietic stem-cell transplantation. Ther Adv Hematol. 2020;11:1-19.
-
Xu D, Chen VL, Steiner CA, Berinstein JA, Eswaran S, Waljee AK et al. Efficacy of Fecal Microbiota Transplantation in Irritable Bowel Syndrome: A Systematic Review and Meta-Analysis. Am J Gastroenterol. 2019;114(7):1043-1050.
-
Sokol H, Landman C, Seksik P, Berard L, Montil M, Nion-Larmurier I et al. Fecal microbiota transplantation to maintain remission in Crohn’s disease: a pilot randomized controlled study. Microbiome. 2020;8(1):12.
-
Scheiman J, Luber JM, Chavkin TA, MacDonald T, Tung A, Pham LD et al. Meta-omics analysis of elite athletes identifies a performance-enhancing microbe that functions via lactate metabolism. Nat Med. 2019;25(7):1104-1109.
-
Kokai-Kun JF, Le C, Trout K, Cope JL, Ajami NJ, Degar AJ, Connelly S. Ribaxamase, an Orally Administered β-Lactamase, Diminishes Changes to Acquired Antimicrobial Resistance of the Gut Resistome in Patients Treated with Ceftriaxone. Infect Drug Resist. 2020;13:2521-2535.
-
de Gunzburg J, Ghozlane A, Ducher A, Le Chatelier E, Duval X, Ruppé E et al. Protection of the Human Gut Microbiome From Antibiotics. J Infect Dis. 2018;217(4):628-636.
-
Dong X, Pan P, Zheng DW, Bao P, Zeng X, Zhang XZ. Bioinorganic hybrid bacteriophage for modulation of intestinal microbiota to remodel tumor-immune microenvironment against colorectal cancer. Sci Adv. 2020;6(20):eaba1590.
-
Ramachandran G, Bikard D. Editing the microbiome the CRISPR way. Philos Trans R Soc Lond B Biol Sci. 2019;374(1772):20180103.
-
Saeidi N, Wong CK, Lo TM, Nguyen HX, Ling H, Leong SS et al. Engineering microbes to sense and eradicate Pseudomonas aeruginosa, a human pathogen. Mol Syst Biol. 2011;7:521.
-
Thompson JA, Oliveira RA, Djukovic A, Ubeda C, Xavier KB. Manipulation of the quorum sensing signal AI-2 affects the antibiotic-treated gut microbiota. Cell Rep. 2015;10(11):1861-71.
-
Burokas A, Arboleya S, Moloney RD, Peterson VL, Murphy K, Clarke G et al. Targeting the Microbiota-Gut-Brain Axis: Prebiotics Have Anxiolytic and Antidepressant-like Effects and Reverse the Impact of Chronic Stress in Mice. Biol Psychiatry. 2017;82(7):472-487.
-
Yu J, Wells J, Wei Z, Fewtrell M. Effects of relaxation therapy on maternal psychological state, infant growth and gut microbiome: protocol for a randomised controlled trial investigating mother-infant signaling during lactation following late preterm and early term delivery. Int Breastfeed J. 2019;14:50.
-
Nguyen N, Zhang B, Holubar SD, Pardi DS, Singh S. Treatment and prevention of pouchitis after ileal pouch-anal anastomosis for chronic ulcerative colitis. Cochrane Database Syst Rev. 2019;5(5):CD001176.
Notes:








Kzhssy
buy atorvastatin online cheap order atorvastatin 40mg sale atorvastatin price
Exqezw
purchase finasteride sale propecia usa diflucan buy online
Zaotri
ciprofloxacin 1000mg over the counter – cephalexin order online amoxiclav order
Xdmrpn
cipro 500mg pills – augmentin 625mg without prescription augmentin 1000mg canada
Cnimgs
buy ciprofloxacin 500 mg – chloramphenicol us brand erythromycin 500mg
Gibjmg
buy metronidazole without a prescription – order terramycin 250mg for sale azithromycin order
Vkvlgh
covid and ivermectin – order cefixime 200mg sale order tetracycline 500mg online cheap
Phoxmg
valacyclovir pill – cost valacyclovir 500mg buy acyclovir 800mg without prescription
Ykramu
purchase ampicillin buy acillin pill order generic amoxicillin
Zhdhxv
flagyl 400mg ca – buy generic cefaclor 500mg order zithromax 500mg without prescription
Ftmgai
buy furosemide 40mg pill – buy cheap generic tacrolimus order captopril 25 mg online
Ofahpz
buy glycomet 1000mg pills – lincomycin 500mg pill order lincocin online cheap
Umrwpt
zidovudine 300mg brand – order epivir 100 mg for sale zyloprim brand
Mvmazd
order clozapine 50mg without prescription – quinapril where to buy famotidine 20mg cheap
Vlwvin
where can i buy seroquel – purchase desyrel pills buy generic eskalith over the counter
Jnvhzw
order clomipramine 50mg online cheap – purchase mirtazapine sale sinequan brand
Wjmmlj
order atarax 10mg without prescription – order buspin for sale buy amitriptyline 10mg sale
Ohfzxl
buy amoxicillin no prescription – erythromycin 500mg cost oral ciprofloxacin 1000mg
Sryugg
buy zithromax 500mg pills – tinidazole 300mg us order ciprofloxacin 500 mg pill
Jzuiaa
buy cleocin 150mg for sale – buy chloramphenicol generic cheap chloramphenicol pill
Onntof
buy ivermectin 6mg – eryc uk buy cefaclor 250mg online cheap
Typjbh
purchase albuterol inhalator sale – order seroflo without prescription order theo-24 Cr generic
Ulroar
methylprednisolone 8 mg pills – oral medrol astelin 10ml generic
Dgslbg
desloratadine order – order beclamethasone albuterol buy online
Fdjika
glyburide 5mg us – order generic glucotrol 5mg order forxiga sale
Pqeelq
order metformin pill – acarbose drug order acarbose 50mg
Btlolb
buy prandin 1mg for sale – where can i buy repaglinide purchase jardiance online
Ymvmfb
rybelsus 14mg canada – purchase glucovance generic buy DDAVP without prescription
Vsvnbu
terbinafine pills – order lamisil griseofulvin online
Ymxagi
generic famvir – how to get valaciclovir without a prescription buy valcivir 500mg without prescription
Ueahxj
lanoxin 250 mg without prescription – order trandate pills buy furosemide diuretic
Tzhmei
brand cialis stray – alprostadil thee penisole lunch
Uxlzae
prostatitis pills gas – prostatitis pills except pills for treat prostatitis amuse
Snvujm
valacyclovir online rough – valtrex online smart valacyclovir pills gear
prodvizhen_vuPn
комплексный аудит сайта https://prodvizhenie-sajtov15.ru/ .
Sefsft
promethazine nostril – promethazine hearty promethazine quiet
Matras_fmpn
сон лайт kupit-matras111.ru .
Iemjli
florinef solemn – protonix pills mystery prevacid pills patch
Sndvwb
rabeprazole 20mg sale – buy generic domperidone order motilium online
Anal_frMr
русское порно анал бесплатно russkiy-anal-x.ru .
Uetung
purchase dulcolax sale – cheap bisacodyl 5 mg buy liv52 for sale
Lakidjet_jjMl
лаки джет 1win лаки джет 1win .
Moshenniki_zfoi
как пожаловаться на мошенников как пожаловаться на мошенников .
Leqvgf
order cotrimoxazole 480mg generic – purchase levetiracetam generic order tobrex for sale
Diplomi_qtki
купить диплом о среднем специальном http://www.russa24-diploms-srednee.com .
Xgbjdz
enalapril buy online – order vasotec without prescription how to get latanoprost without a prescription
Ykzrjo
buy generic etodolac 600 mg – buy generic etodolac online pletal canada
Ujmnys
feldene 20mg uk – generic feldene 20mg buy rivastigmine pills
crazymonkey_qkSi
слот крейзи манки https://crazy-monkey-ru.ru/ .
Stephentet
Каждый год в середине сентября организовывается Тюменский инновационный форум «НЕФТЬГАЗТЭК».
Форум посвящен определению мнтодов инноваторского роста отраслей топливно-энергетического комплекса, рассмотрению и изысканию решений, созданию наилучших условий для формирования инновационных проектов. Ежегодный тюменский форум представляетсобой важной дискуссионной площадкой по увеличению роста нефтегазовой ветви в Российской Федерации, содержит высокий авторитет и своевременность, созвучен корпоративной стратегии формирования инноваторского направления в Российской Федерации
-https://neftgaztek.ru/
anal_cukt
анал с разговорами на русском языке анал с разговорами на русском языке .
Diplomi_lami
купить диплом о среднем образовании http://school5-priozersk.ru .
jirosjigatel_ivor
таблетки для похудения купить таблетки для похудения купить .
luckyjet_jbOr
lucky jet lucky jet .
aviator_cemt
what is aviator game what is aviator game .
Diplomi_wgPl
где купить диплом о высшем образовании где купить диплом о высшем образовании .
semarak
I came across an article that talks about the same thing but even more and when you go deeper.
Zamok_ezsl
открыть замок москва https://vskrytie-zamkov-moskva113.ru/ .
Larrynub
pin up apk yukle: pin-up 306 – pin-up kazino
AlbertVof
pin-up 141 https://azerbaijancuisine.com/# pin up 306
pin up yukle
Saiti_eisa
продвижение сайтов интернет магазины в москве продвижение сайтов интернет магазины в москве .
Uaeayl
purchase piracetam for sale – buy secnidazole 20mg buy sinemet
santosa
whoah this weblog is great i really like studying your articles. Stay up the great work! You already know, lots of persons are looking round for this information, you can aid them greatly.
Williamadvam
reputable mexican pharmacies online: northern doctors pharmacy – medication from mexico pharmacy
Jeffreymycle
http://northern-doctors.org/# mexican drugstore online
Williamadvam
mexico drug stores pharmacies: п»їbest mexican online pharmacies – mexico drug stores pharmacies
Jeffreymycle
https://northern-doctors.org/# mexican pharmaceuticals online
Williamadvam
medicine in mexico pharmacies: Mexico pharmacy that ship to usa – п»їbest mexican online pharmacies
RichardJeave
п»їbest mexican online pharmacies mexican pharmacy medicine in mexico pharmacies
Williamadvam
medication from mexico pharmacy: Mexico pharmacy that ship to usa – buying prescription drugs in mexico online
Jeffreymycle
https://northern-doctors.org/# mexico pharmacy
Williamadvam
mexican pharmacy: northern doctors – reputable mexican pharmacies online
Williamadvam
mexican drugstore online: mexican pharmacy northern doctors – reputable mexican pharmacies online
Diplom_iher
купить диплом массажиста vm-tver.ru .
Jeffreymycle
https://northern-doctors.org/# best online pharmacies in mexico
Williamadvam
mexican rx online: mexican northern doctors – buying prescription drugs in mexico online
Jeffreymycle
https://northern-doctors.org/# mexican drugstore online
RichardJeave
buying prescription drugs in mexico online northern doctors mexico drug stores pharmacies
Yauudv
order generic hydroxyurea – disulfiram 250mg canada buy cheap robaxin
Jeffreymycle
https://northern-doctors.org/# mexican rx online
RichardJeave
purple pharmacy mexico price list northern doctors mexico pharmacies prescription drugs
Jeffreymycle
https://northern-doctors.org/# mexico drug stores pharmacies
Jeffreymycle
https://northern-doctors.org/# mexico pharmacy
Jeffreymycle
http://northern-doctors.org/# mexican border pharmacies shipping to usa
RichardJeave
mexico drug stores pharmacies mexican pharmacy pharmacies in mexico that ship to usa
Pereezd_irml
перевозка мебели минск перевозка мебели минск .
Jeffreymycle
https://northern-doctors.org/# mexico pharmacies prescription drugs
Jeffreymycle
https://northern-doctors.org/# buying from online mexican pharmacy
Jeffreymycle
http://northern-doctors.org/# mexican drugstore online
Oborydovanie_btot
оборудование для сцены актового зала http://www.oborudovanie-aktovogo-zala13.ru .
RichardJeave
medicine in mexico pharmacies northern doctors mexican rx online
Jeffreymycle
https://northern-doctors.org/# reputable mexican pharmacies online
Jeffreymycle
http://northern-doctors.org/# mexico pharmacy
Jeffreymycle
https://northern-doctors.org/# mexican border pharmacies shipping to usa
Jeffreyrig
http://cmqpharma.com/# mexican rx online
mexican online pharmacies prescription drugs
Ronniesig
pharmacies in mexico that ship to usa online mexican pharmacy mexico pharmacies prescription drugs
StephenLob
mexican border pharmacies shipping to usa: mexican online pharmacy – mexican online pharmacies prescription drugs
Ronniesig
mexican mail order pharmacies mexico pharmacy purple pharmacy mexico price list
Aifoni_ffOt
сервисы по ремонту айфонов http://www.iphonepochinka.by/ .
Ronniesig
mexico drug stores pharmacies mexico pharmacy purple pharmacy mexico price list
Opbfqy
depakote cost – brand lariam topamax 100mg sale
Donaldfrono
best online pharmacies in mexico
http://cmqpharma.com/# mexico pharmacies prescription drugs
pharmacies in mexico that ship to usa
Ronniesig
mexican online pharmacies prescription drugs cmq pharma mexico drug stores pharmacies
Ronniesig
best online pharmacies in mexico purple pharmacy mexico price list buying prescription drugs in mexico online
Ronniesig
purple pharmacy mexico price list mexican pharmacy online best online pharmacies in mexico
Wblasz
disopyramide phosphate sale – generic pregabalin 150mg order chlorpromazine 100mg online
DonaldCusty
Профессиональные seo https://seo-optimizaciya-kazan.ru услуги для максимизации онлайн-видимости вашего бизнеса. Наши эксперты проведут глубокий анализ сайта, оптимизируют контент и структуру, улучшат технические аспекты и разработают индивидуальные стратегии продвижения.
Ronniesig
reputable mexican pharmacies online cmq pharma mexico pharmacies prescription drugs
Ijxtkt
cyclophosphamide cost – trimetazidine sale buy trimetazidine generic
Jchjvi
spironolactone 25mg price – order dipyridamole generic buy generic naltrexone
Stephansoype
Top sports news https://idman-azerbaycan.com.az photos and blogs from experts and famous athletes, as well as statistics and information about matches of leading championships.
HectorBes
Latest news and details about the NBA in Azerbaijan https://nba.com.az. Hot events, player transfers and the most interesting events. Explore the world of the NBA with us.
EddieTob
Discover the fascinating world of online games with GameHub Azerbaijan https://online-game.com.az. Get the latest news, reviews and tips for your favorite games. Join our gaming community today!
Jamesmex
The latest top football news https://futbol.com.az today. Interviews with football players, online broadcasts and match results, analytics and football forecasts, photos and videos.
DesmondBelve
Каталог рейтингов хостингов https://pro-hosting.tech на любой вкус и под любые, даже самые сложные, задачи.
Jordanglona
Сантехник — вызов сантехника на дом в Москве и Московской области в удобное для вас время.
Harryalage
Play PUBG Mobile https://pubg-mobile.com.az an exciting world of high-quality mobile battle royale. Unique maps, strategies and intense combat await you in this exciting mobile version of the popular game.
Oscarhic
The Dota 2 website https://dota2.com.az Azerbaijan provides the most detailed information about the latest game updates, tournaments and upcoming events. We have all the winning tactics, secrets and important guides.
Brucesiz
Latest news about games for Android https://android-games.com.az, reviews and daily updates. Read now and get the latest information on the most exciting games
Leroydably
Check out the latest news, guides and in-depth reviews of the available options for playing Minecraft Az https://minecraft.com.az. Find the latest information about Minecraft Download, Pocket Edition and Bedrock Edition.
Raphaelcaw
The most popular sports site https://sports.com.az of Azerbaijan, where the latest sports news, forecasts and analysis are collected.
Barryimpot
Latest news and analytics of the Premier League https://premier-league.com.az. Detailed descriptions of matches, team statistics and the most interesting football events. EPL Azerbaijan is the best place for football fans.
Charleszed
Хотите сделать в квартире ремонт? Тогда советуем вам посетить сайт https://stroyka-gid.ru, где вы найдете всю необходимую информацию по строительству и ремонту.
VictorBup
https://LoveFlover.ru — сайт посвященный комнатным растениям. Предлагает подробные статьи о выборе, выращивании и уходе за различными видами комнатных растений. Здесь можно найти полезные советы по созданию зелёного уголка в доме, руководства по декору и решению распространённых проблем, а также информацию о подходящих горшках и удобрениях. Платформа помогает создавать уютную атмосферу и гармонию в интерьере с помощью растений.
RobertFum
Pin Up official https://pin-up.adb-auto.ru website. Login to your personal account and register through the Pin Up mirror. Slot machines for real money at Pinup online casino.
GeorgeAnild
Pin-up Casino https://pin-up.admsov.ru/ is an online casino licensed and regulated by the government of Curacao . Founded in 2016, it is home to some of the industry’s leading providers, including NetEnt, Microgaming, Play’n GO and others. This means that you will be spoiled for choice when it comes to choosing a game.
MichaelMoory
Pin Up online casino https://pin-up.webrabota77.ru/ is the official website of a popular gambling establishment for players from the CIS countries. The site features thousands of slot machines, online tables and other branded entertainment from Pin Up casino.
Colinbolla
Pin Up Casino https://pin-up.noko39.ru Registration and Login to the Official Pin Up Website. thousands of slot machines, online tables and other branded entertainment from Pin Up casino. Come play and get big bonuses from the Pinup brand today
Jeffreyked
Реальные анкеты проституток https://prostitutki-213.ru Москвы с проверенными фото – от элитных путан до дешевых шлюх. Каталог всех индивидуалок на каждой станции метро с реальными фотографиями без ретуши и с отзывами реальных клиентов.
Matthewsmise
Смотрите онлайн сериал Отчаянные домохозяйки https://domohozyayki-serial.ru в хорошем качестве HD 720 бесплатно, рейтинг сериала: 8.058, режиссер сериала: Дэвид Гроссман, Ларри Шоу, Дэвид Уоррен.
Jeffreytum
Buy TikTok followers https://tiktok-followers-buy.com to get popular and viral with your content. All packages are real and cheap — instant delivery within minutes. HQ followers for your TikTok. 100% real users. The lowest price for TikTok followers on the market
VictorItene
Pin Up Casino https://pin-up.sibelshield.ru official online casino website for players from the CIS countries. Login and registration to the Pin Up casino website is open to new users with bonuses and promotional free spins.
MilesRex
Pin Up https://pin-up.fotoevolution.ru казино, которое радует гемблеров в России на протяжении нескольких лет. Узнайте, что оно подготовило посетителям. Описание, бонусы, отзывы о легендарном проекте. Регистрация и вход.
Jameskem
Изготовление памятников и надгробий https://uralmegalit.ru по низким ценам. Собственное производство. Высокое качество, широкий ассортимент, скидки, установка.
Georgerooks
Pin Up Casino https://pin-up.ergojournal.ru приглашает игроков зарегистрироваться на официальном сайте и начать играть на деньги в лучшие игровые автоматы, а на зеркалах онлайн казино Пин Ап можно найти аналогичную витрину слотов
TerryRaday
Pin-up casino https://pin-up.jes-design.ru популярное онлайн-казино и ставки на спорт. Официальный сайт казино для доступа к играм и другим функциям казино для игры на деньги.
Ryan McLaughlin
I have been curious about these trends, and you have really helped me. I have just told a few of my friends about this on FaceBook and they love your content just as much as I do.
JesseCip
Открой мир карточных игр в Pin-Up https://pin-up.porsamedlab.ru казино Блэкджек, Баккара, Хило и другие карточные развлечения. Регистрируйтесь и играйте онлайн!
Robertfaini
Официальный сайт Pin Up казино https://pin-up.nasledie-smolensk.ru предлагает широкий выбор игр и щедрые бонусы для игроков. Уникальные бонусные предложения, онлайн регистрация.
Williamfag
Pinup казино https://pin-up.vcabinet.kz это не просто сайт, а целый мир азартных развлечений, где каждый может найти что-то свое. От традиционных игровых автоматов до прогнозов на самые популярные спортивные события.
MichaelPeaws
Latest Diablo news https://diablo.com.az game descriptions and guides. Diablo.az is the largest Diablo portal in the Azerbaijani language.
Marvinwer
Latest World of Warcraft (WOW) tournament news https://wow.com.az, strategies and game analysis. The most detailed gaming portal in Azerbaijani language
WillieNeump
Azerbaijan NFL https://nfl.com.az News, analysis and topics about the latest experience, victories and records. A portal where the most beautiful NFL games in the world are generally studied.
Robertfaini
Discover exciting virtual football in Fortnite https://fortnite.com.az. Your central hub for the latest news, expert strategies and interesting e-sports reports. Collecting points with us!
JamesMem
The latest analysis, tournament reviews and the most interesting features of the Spider-Man game https://spider-man.com.az series in Azerbaijani.
WilliamVed
Read the latest Counter-Strike 2 news https://counter-strike.net.az, watch the most successful tournaments and become the best in the world of the game on the CS2 Azerbaijan website.
BryonRes
Mesut Ozil https://mesut-ozil.com.az latest news, statistics, photos and much more. Get the latest news and information about one of the best football players Mesut Ozil.
RogerViofs
Explore the extraordinary journey of Kilian Mbappe https://kilian-mbappe.com.az, from his humble beginnings to global stardom. Delve into his early years, meteoric rise through the ranks, and impact on and off the football field.
ArthurHow
Latest news, statistics, photos and much more about Pele https://pele.com.az. Get the latest news and information about football legend Pele.
Davidjag
Latest boxing news https://boks.com.az, Resul Abbasov’s achievements, Tyson Fury’s fights and much more. All in Ambassador Boxing.
Robertohaw
Sergio Ramos Garcia https://sergio-ramos.com.az Spanish footballer, defender. Former Spanish national team player. He played for 16 seasons as a central defender for Real Madrid, where he captained for six seasons.
JeffreyMaf
Gianluigi Buffon https://buffon.com.az Italian football player, goalkeeper. Considered one of the best goalkeepers of all time. He holds the record for the number of games in the Italian Championship, as well as the number of minutes in this tournament without conceding a goal.
JamesTek
Paulo Bruno Ezequiel Dybala https://dybala.com.az Argentine footballer, striker for the Italian club Roma and the Argentina national team. World champion 2022.
WilliamCix
Paul Labille Pogba https://pogba.com.az French footballer, central midfielder of the Italian club Juventus. Currently suspended for doping and unable to play. World champion 2018.
KennethNix
Kevin De Bruyne https://kevin-de-bruyne.liverpool-fr.com Belgian footballer, born 28 June 1991 years in Ghent. He has had a brilliant club career and also plays for the Belgium national team. De Bruyne is known for his spectacular goals and brilliant assists.
WilliamRem
Канал для того, чтобы знания и опыт, могли помочь любому человеку сделать ремонт https://tvin270584.livejournal.com в своем жилище, любой сложности!
Georgegen
Mohamed Salah Hamed Mehrez Ghali https://mohamed-salah.liverpool-fr.com Footballeur egyptien, attaquant du club anglais de Liverpool et l’equipe nationale egyptienne. Considere comme l’un des meilleurs joueurs du monde.
Billydib
Paul Labille Pogba https://paul-pogba.psg-fr.com Footballeur francais, milieu de terrain central du club italien de la Juventus. Champion du monde 2018. Actuellement suspendu pour dopage et incapable de jouer.
WilliamCix
The young talent who conquered Paris Saint-Germain: how Xavi Simons became https://xavi-simons.psg-fr.com leader of a superclub in record time.
DavidNap
Kylian Mbappe https://kylian-mbappe.psg-fr.com Footballeur, attaquant francais. Il joue pour le PSG et l’equipe de France. Ne le 20 decembre 1998 a Paris. Mbappe est francais de nationalite. La taille de l’athlete est de 178 cm.
Kennethmucky
Kevin De Bruyne https://liverpool.kevin-de-bruyne-fr.com Belgian footballer, born 28 June 1991 years in Ghent. He has had a brilliant club career and also plays for the Belgium national team. De Bruyne is known for his spectacular goals and brilliant assists.
Billydib
Paul Pogba https://psg.paul-pogba-fr.com is a world-famous football player who plays as a central midfielder. The player’s career had its share of ups and downs, but he was always distinguished by his perseverance and desire to win.
MichaelDEW
Kylian Mbappe https://psg.kylian-mbappe-fr.com Footballeur, attaquant francais. L’attaquant de l’equipe de France Kylian Mbappe a longtemps refuse de signer un nouveau contrat avec le PSG, l’accord etant en vigueur jusqu’a l’ete 2022.
LucioAloms
Изготовление, сборка и ремонт мебели https://shkafy-na-zakaz.blogspot.com для Вас, от эконом до премиум класса.
Kennethmucky
Thibaut Nicolas Marc Courtois https://thibaut-courtois.real-madrid-ar.com Footballeur belge, gardien de but du Club espagnol “Real Madrid”. Lors de la saison 2010/11, il a ete reconnu comme le meilleur gardien de la Pro League belge, ainsi que comme joueur de l’annee pour Genk. Trois fois vainqueur du Trophee Ricardo Zamora, decerne chaque annee au meilleur gardien espagnol
Robertaliff
Forward Rodrigo https://rodrygo.real-madrid-ar.com is now rightfully considered a rising star of Real Madrid. The talented Santos graduate is compared to Neymar and Cristiano Ronaldo, but the young talent does not consider himself a star.
DarrinfeS
Jude Victor William Bellingham https://jude-bellingham.real-madrid-ar.com English footballer, midfielder of the Spanish club Real Madrid and the England national team. In April 2024, he won the Breakthrough of the Year award from the Laureus World Sports Awards.
SamuelSen
Saud Abdullah Abdulhamid https://saud-abdulhamid.real-madrid-ar.com Saudi footballer, defender of the Al -Hilal” and the Saudi Arabian national team. Asian champion in the age category up to 19 years. Abdulhamid is a graduate of the Al-Ittihad club. On December 14, 2018, he made his debut in the Saudi Pro League in a match against Al Bateen
Donaldlot
Khvicha Kvaratskhelia https://khvicha-kvaratskhelia.real-madrid-ar.com midfielder of the Georgian national football team and the Italian club “Napoli”. Became champion of Italy and best player in Serie A in the 2022/23 season. Kvaratskhelia is a graduate of Dynamo Tbilisi and played for the Rustavi team.
Zuqemz
flexeril order online – zyprexa price purchase enalapril sale
MartinHaugs
Vinicius Junior https://vinisius-junior.com.az player news, fresh current and latest events for today about the player of the 2024 season
Rodolforuddy
Latest news and information about Marcelo https://marcelo.com.az on this site! Find Marcelo’s biography, career, playing stats and more. Find out the latest information about football master Marcelo with us!
AnthonyNency
Khabib Abdulmanapovich Nurmagomedov https://khabib-nurmagomedov.com.az Russian mixed martial arts fighter who performed under the auspices of the UFC. Former UFC lightweight champion.
Kelvingon
Welcome to our official site! Get to know the history, players and latest news of Inter Miami Football Club https://inter-miami.com.az. Discover with us the successes and great performances of America’s newest and most exciting soccer club.
Arturospumb
Conor Anthony McGregor https://conor-mcgregor.com.az Irish mixed martial arts fighter who also performed in professional boxing. He performs under the auspices of the UFC in the lightweight weight category. Former UFC lightweight and featherweight champion.
AnthonyGon
Оперативный вывод из запоя https://www.liveinternet.ru/users/laralim/post505923855/ на дому. Срочный выезд частного опытного нарколога круглосуточно. При необходимости больного госпитализируют в стационар.
Justingut
Заказать вывоз мусора https://musorovozzz.ru в Москве и Московской области, недорого и в любое время суток в мешках или контейнерами 8 м?, 20 м?, 27 м?, 38 м?, собственный автопарк. Заключаем договора на вывоз мусора.
Arturospumb
Реальные анкеты https://prostitutki-vyzvat-moskva.ru Москвы с проверенными фото – от элитных путан до дешевых шлюх. Каталог всех индивидуалок на каждой станции метро с реальными фотографиями без ретуши и с отзывами реальных клиентов.
Anthonybyday
Совсем недавно открылся новый интернет портал BlackSprut (Блекспрут) https://bs2cite.cc в даркнете, который предлагает купить нелегальные товары и заказать запрещенные услуги. Самая крупнейшая площадка СНГ. Любимые шопы и отзывчивая поддержка.
Raymondurile
Welcome to the site dedicated to Michael Jordan https://michael-jordan.com.az, a basketball legend and symbol of world sports culture. Here you will find highlights, career, family and news about one of the greatest athletes of all time.
JerryWhicy
Diego Armando Maradona https://diego-maradona.com.az Argentine footballer who played as an attacking midfielder and striker. He played for the clubs Argentinos Juniors, Boca Juniors, Barcelona, ??Napoli, and Sevilla.
Dennistax
Gucci купить http://thebestluxurystores.ru по низкой цене в интернет-магазине брендовой одежды. Одежда и обувь бренда Gucci c доставкой.
EnriqueOnevy
Muhammad Ali https://muhammad-ali.com.az American professional boxer who competed in the heavy weight category; one of the most famous boxers in the history of world boxing.
Chrisfug
Монтаж систем отопления https://fectum.pro, водоснабжения, вентиляции, канализации, очистки воды, пылеудаления, снеготаяния, гелиосистем в Краснодаре под ключ.
Brettbon
Lev Ivanovich Yashin https://lev-yashin.com.az Soviet football player, goalkeeper. Olympic champion in 1956 and European champion in 1960, five-time champion of the USSR, three-time winner of the USSR Cup.
Edgarsug
Al-Nasr https://al-nasr.com.az your source of news and information about Al-Nasr Football Club . Find out the latest results, transfer news, player and manager interviews, fixtures and much more.
Philliplorne
Usain St. Leo Bolt https://usain-bolt.com.az Jamaican track and field athlete, specialized in short-distance running, eight-time Olympic champion and 11-time world champion (a record in the history of this competition among men).
RobertMeash
Game World https://kz-games.kz offers the latest online gaming news, game reviews, gameplay and ideas, gaming tactics and tips . Start playing our most popular and amazing games and get ready to become the leader in the online gaming world!
Donaldvulge
You have a source of the latest and most interesting sports news from Kazakhstan: “Kazakhstan sports news https://sports-kazahstan.kz: Games and records” ! Follow us to receive updates and interesting news every minute!
CharlesBok
Latest news and information about the NBA https://basketball-kz.kz in Kazakhstan. Hot stories, player transfers and highlights. Watch the NBA world with us.
RodneyAluch
Top sports news https://sport-kz-news.kz, photos and blogs from experts and famous athletes, as well as statistics and information about matches of leading championships.
HarryNob
The latest top football news https://football-kz.kz today. Interviews with football players, online broadcasts and match results, analytics and football forecasts, photos and videos.
LeslieCox
Latest news about games for Android https://android-games.kz, reviews and daily updates. Read now and get the latest information about the most exciting games
ThomasAmani
Check out Minecraft kz https://minecraft-kz.kz for the latest news, guides, and in-depth reviews of the game options available. Find the latest information on Minecraft Download, Pocket Edition and Bedrock Edition.
JefferyErect
Latest news from World of Warcraft https://wow-kz.kz (WOW) tournaments, strategy and game analysis. The most detailed gaming portal in the language.
BrettHuddy
Latest news and analysis of the Premier League https://premier-league.kz. Full descriptions of matches, team statistics and the most interesting football events. Premier Kazakhstan is the best place for football fans.
Thomaszen
Доставка груза и грузоперевозки https://tamozhennyy-deklarant.blogspot.com по России через транспортную компанию автотранспортом доступна и для частных лиц. Перевозчик отправит или доставит ваш груз: выгодные тарифы индивидуальный подход из рук в руки 1 машиной.
MichaelJof
Зеркала интерьерные https://zerkala-mag.ru в интернет-магазине «Зеркала с подсветкой» Самые низкие цены на зеркала!
JamesMar
Предлагаем купить гаражное оборудование https://profcomplex.pro, автохимию, технику и уборочный инвентарь для клининговых компаний. Доставка по Москве и другим городам России.
Kennethfen
Купить зеркала https://zerkala-m.ru по низким ценам. Более 1980 моделей, купить недорого в интернет-магазине в Москве с доставкой по России. Удобный каталог, низкие цены, качественные фото.
LewisDrype
Spider-Man https://spiderman.kz the latest news, articles, reviews, dates, spoilers and other latest information. All materials on the topic “Spider-Man”
StaceyImmub
Latest Counter-Strike 2 news https://counter-strike-kz.kz, watch the most successful tournaments and be the best in the gaming world.
HerbertMeedy
The latest top football news https://football.sport-news-eg.com today. Interviews with football players, online broadcasts and match results, analytics and football forecasts, photos and videos.
Albertopruri
Discover the dynamic world of Arab sports https://sports-ar.com through the lens of Arab sports news. Your premier source for breaking news, exclusive interviews, in-depth analysis and live coverage of everything happening in sports.
Arrnyy
buy zofran 8mg pills – purchase selegiline online cheap ropinirole drug
PatrickRof
Интернет магазин электроники https://techno-line.store и цифровой техники по доступным ценам. Доставка мобильной электроники по Москве и Московской области.
Jasoncum
NHL news https://nhl-ar.com (National Hockey League) – the latest and most up-to-date NHL news for today.
KermitJat
UFC news https://ufc-ar.com, schedule of fights and tournaments 2024, ratings of UFC fighters, interviews, photos and videos. Live broadcasts and broadcasts of tournaments, statistics, forums and fan blogs.
RonaldCrors
The most important sports news https://bein-sport-egypt.com, photos and blogs from experts and famous athletes, as well as statistics and information about matches of leading leagues.
RichardBog
News and events of the American Basketball League https://basketball-eg.com in Egypt. Hot events, player transfers and the most interesting events. Explore the world of the NBA with us.
WilliamQualm
Discover the wonderful world of online games https://game-news-ar.com. Get the latest news, reviews and tips for your favorite games.
Brandonphymn
News, tournaments, guides and strategies about the latest GTA games https://gta-ar.com. Stay tuned for the best GTA gaming experience
RonnieStict
Открытие для себя Ерлинг Хааланда https://manchestercity.erling-haaland-cz.com, a talented player of «Manchester City». Learn more about his skills, achievements and career growth.
Scotttrest
The path of 21-year-old Jude Bellingham https://realmadrid.jude-bellingham-cz.com from young talent to one of the most promising players in the world, reaching new heights with Dortmund and England.
Charlesvep
The site is dedicated to football https://fooball-egypt.com, football history and news. Latest news and fresh reviews of the world of football
Aarontam
Harry Kane’s journey https://bavaria.harry-kane-cz.com from Tottenham’s leading striker to Bayern’s leader and Champions League champion – this is the story of a triumphant ascent to the football Olympus.
RobertPex
Изготовим для Вас изделия из металла https://smith-moskva.blogspot.com, по вашим чертежам или по нашим эскизам.
JamesEcota
Промышленные насосы https://superomsk.ru/news/137099/pogrujne_nasos/ Wilo предлагают широкий ассортимент решений для различных отраслей промышленности, включая водоснабжение, отопление, вентиляцию, кондиционирование и многие другие. Благодаря своей высокой производительности и эффективности, насосы Wilo помогают снизить расходы на энергию и обслуживание, что делает их идеальным выбором для вашего бизнеса.
ThomasPethy
https://buzard.ru панели для отделки фасада – интернет магазин
Patrickker
The fascinating story of the rise of Brazilian prodigy Vinicius Junior https://realmadrid.vinicius-junior-cz.com to the heights of glory as part of the legendary Madrid “Real”
dolce gabbana_urKi
Где купить Дольче Габбана http://scm-fashion.ru/ .
WilliamOntom
Mohamed Salah https://liverpool.mohamed-salah-cz.com, who grew up in a small town in Egypt, conquered Europe and became Liverpool star and one of the best players in the world.
Hermanhob
The inspiring story of how talented Kevin De Bruyne https://manchestercity.kevin-de-bruyne-cz.com became the best player of Manchester City and the Belgium national team. From humble origins to the leader of a top club.
RobbieNug
Полезные советы и пошаговые инструкции по строительству https://svoyugol.by, ремонту и дизайну домов и квартир, выбору материалов, монтажу и установке своими руками.
OrvilleAdods
Lionel Messi https://intermiami.lionel-messi-cz.com, one of the best football players of all time, moves to Inter Miami” and changes the face of North American football.
BrianCrazy
Bernardo Mota Veiga de Carvalho e Silva https://manchestercity.bernardo-silva-cz.com Portuguese footballer, club midfielder Manchester City and the Portuguese national team.
Williamcoese
Son Heung-min’s https://tottenhamhotspur.son-heung-min-cz.com success story at Tottenham Hotspur and his influence on the South Korean football, youth inspiration and changing the perception of Asian players.
Dgykiz
ascorbic acid generic – cheap bromhexine for sale prochlorperazine for sale
RaymondSor
The impact of the arrival of Cristiano Ronaldo https://annasr.cristiano-ronaldo-cz.com at Al-Nasr. From sporting triumphs to cultural changes in Saudi football.
Curtislar
We explore the path of Luka Modric https://realmadrid.luka-modric-cz.com to Real Madrid, from a difficult adaptation to legendary Champions League triumphs and personal awards.
Anthonyhox
Find out how Pedri https://barcelona.pedri-cz.com becomes a key figure for Barcelona – his development, influence and ambitions determine the club’s future success in world football.
Robertslups
How Karim Benzema https://alIttihad.karim-benzema-cz.com changed the game of Al-Ittihad and Saudi football: new tactics, championship success, increased viewership and commercial success.
JasperVence
Find out about Alisson https://liverpool.alisson-becker-cz.com‘s influence on Liverpool’s success, from his defense to personal achievements that made him one of the best goalkeepers in the world.
Waynelew
Find out how Pedro Gavi https://barcelona.gavi-cz.com helped Barcelona achieve success thanks to his unique qualities, technique and leadership, becoming a key player in the team.
Travisloano
r7 casino регистрация https://mabiclub.ru
DennisNange
buy 200 instagram views buy instagram likes
GeorgeCob
Thibaut Courtois https://realmadrid.thibaut-courtois-cz.com the indispensable goalkeeper of “Real”, whose reliability, leadership and outstanding The game made him a key figure in the club.
JamesKex
Find out how Virgil van Dijk https://liverpool.virgil-van-dijk-cz.com became an integral part of style игры «Liverpool», ensuring the stability and success of the team.
JoshuaDen
Study of the playing style of Toni Kroos https://real-madrid.toni-kroos-cz.com at Real Madrid: his accurate passing, tactical flexibility and influence on the team’s success.
Curtisfloog
Romelu Lukaku https://chelsea.romelu-lukaku-cz.com, one of the best strikers in Europe, returns to Chelsea to continue climbing to the top of the football Olympus.
WalterAmete
The young Uruguayan Darwin Nunez https://liverpool.darwin-nunez-cz.com broke into the elite of world football, and he became a key Liverpool player.
JimmyLum
Star Brazilian striker Gabriel Jesus https://arsenal.gabriel-jesus-cz.com put in a superb performance to lead Arsenal to new heights after moving from Manchester City.
Jaimeglold
A fascinating story about how David Alaba https://realmadrid.david-alaba-cz.com after starting his career at the Austrian academy Vienna became a key player and leader of the legendary Real Madrid.
wow raid carry_klpi
wow raid boost service http://www.kreativwerkstatt-esens.de .
KennethTougs
The story of how the incredibly talented footballer Riyad Mahrez https://alahli.riyad-mahrez-cz.com reached new heights in career, moving to Al Ahly and leading the team to victory.
KeithSIz
The fascinating story of Antonio Rudiger’s transfer https://real-madrid.antonio-rudiger-cz.com to Real Madrid and his rapid rise as a key player at one of the best clubs in the world.
Zacherygroms
The fascinating story of Marcus Rashford’s ascent https://manchester-united.marcus-rashford-cz.com to glory in the Red Devils: from a young talent to one of the key players of the team.
Robertapoda
Fascinating event related to this Keanu Reeves helped him in the role of the iconic John Wick characters https://john-wick.keanu-reeves.cz, among which there is another talent who has combat smarts with inappropriate charisma.
CalvinstOge
Try to make a fascinating actor Johnny Depp https://secret-window.johnny-depp.cz, who will become the slave of his strong hero Moudriho Creeps in the thriller “Secret Window”.
Richarddar
Jackie Chan https://peakhour.jackie-chan.cz from a poor boy from Hong Kong to a world famous Hollywood stuntman. The incredible success story of Jackie Chan.
DavidIminc
Follow Liam Neeson’s career https://hostage.liam-neeson.cz as he fulfills his potential as Brian Mills in the film “Taken” and becomes one of the leading stars of Hollywood action films.
Robertdriff
Emily Olivia Laura Blunt https://oppenheimer.emily-blunt.cz British and American actress. Winner of the Golden Globe (2007) and Screen Actors Guild (2019) awards.
GarryUphog
The inspiring story of Zendaya’s rise https://spider-man.zendaya-maree.cz, from her early roles to her blockbuster debut in Marvel Cinematic Universe.
Derricksep
The inspiring story of the ascent of the young actress Anya Taylor https://queensmove.anya-taylor-joy.cz to fame after her breakthrough performance in the TV series “The Queen’s Move”. Conquering new peaks.
Edwardgam
An indomitable spirit, incredible skills and five championships – how Kobe Bryant https://losangeles-lakers.kobe-bryant.cz became an icon of the Los Angeles Lakers and the entire NBA world.
DariusDal
Carlos Vemola https://oktagon-mma.karlos-vemola.cz Czech professional mixed martial artist, former bodybuilder, wrestler and member Sokol.
Raymondaudic
Witness the thrilling story of Jiri Prochazka’s https://ufc.jiri-prochazka-ufc.cz rapid rise to the top of the UFC’s light heavyweight division, marked by his dynamic fighting style and relentless determination.
StacyKic
Jon Jones https://ufc.jon-jones.cz a dominant fighter with unrivaled skill, technique and physique who has conquered the light heavyweight division.
Henrypem
An article about the triumphant 2023 Ferrari https://ferrari.charles-leclerc.cz and their star driver Charles Leclerc, who became the Formula world champion 1.
DouglasLause
The legendary Spanish racer Fernando Alonso https://formula-1.fernando-alonso.cz returns to Formula 1 after several years.
EarnestSmexY
Young Briton Lando Norris https://mclaren.lando-norris.cz is at the heart of McLaren’s Formula 1 renaissance, regularly achieving podium finishes and winning.
Jamessab
Activision and Call of Duty https://activision.call-of-duty.cz leading video game publisher and iconic shooter with a long history market dominance.
JosephDox
seljanovo https://montenegro-real-estate-prices.com
Williamneini
the most popular sports website https://sports-forecasts.com in the Arab world with the latest sports news, predictions and analysis in real time.
RobertMug
Free movies https://www.moviesjoy.cc and TV streaming online, watch movies online in HD 1080p.
AaronWhole
Latest news and analysis of the English Premier League https://epl-ar.com. Detailed descriptions of matches, team statistics and the most interesting football events.
JamesLor
Latest Diablo news https://diablo-ar.com, detailed game descriptions and guides. Diablo.az – The largest Diablo information portal in Arabic.
DavidBet
Latest World of Warcraft tournament news https://ar-wow.com (WOW), strategies and game analysis. The most detailed gaming portal in Arabic.
RosarioRoaby
The latest analysis, reviews of https://spider-man-ar.com tournaments and the most interesting things from the “Spider-Man” series of games in Azerbaijani language. It’s all here!
Eddieoweft
NFL https://nfl-ar.com News, analysis and topics about the latest practices, victories and records. A portal that explores the most beautiful games in the NFL world in general.
Jamesbow
Discover exciting virtual football https://fortnite-ar.com in Fortnite. Your central hub for the latest news, expert strategy and exciting eSports reporting.
Robertmarry
Latest Counter-Strike 2 news https://counter-strike-ar.com, watch the most successful tournaments and be the best in the gaming world on CS2 ar.
Wfhypt
how to purchase durex gel – buy xalatan eye drops xalatan usa
RaymondALUMN
Latest boxing news, achievements of Raisol Abbasov https://boxing-ar.com, Tyson Fury fights and much more. It’s all about the boxing ambassador.
ScottDap
Discover the wonderful world of online games https://onlayn-oyinlar.com with GameHub. Get the latest news, reviews and tips for your favorite games. Join our gaming community today!
JoshuaHaf
Sports news https://gta-uzbek.com the most respected sports site in Uzbekistan, which contains the latest sports news, forecasts and analysis.
KennethAneme
Latest news from the world of boxing https://boks-uz.com, achievements of Resul Abbasov, Tyson Fury’s fights and much more. Everything Boxing Ambassador has.
JamesDex
Latest GTA game news https://gta-uzbek.com, tournaments, guides and strategies. Stay tuned for the best GTA gaming experience
JamesDiobe
Explore the extraordinary journey of Kylian Mbappe https://mbappe-real-madrid.com, from his humble beginnings to global stardom.
PhillipMip
Latest news about Pele https://mesut-ozil-uz.com, statistics, photos and much more. Get the latest news and information about football legend Pele.
Stevenirral
Get the latest https://mesut-ozil-uz.com Mesut Ozil news, stats, photos and more.
Stevenraibe
Serxio Ramos Garsiya https://serxio-ramos.com ispaniyalik futbolchi, himoyachi. Ispaniya terma jamoasining sobiq futbolchisi. 16 mavsum davomida u “Real Madrid”da markaziy himoyachi sifatida o’ynadi.
RobertMix
Ronaldo de Asis Moreira https://ronaldinyo.com braziliyalik futbolchi, yarim himoyachi va hujumchi sifatida o’ynagan. Jahon chempioni (2002). “Oltin to’p” sovrindori (2005).
OrlandoNit
Официальный сайт онлайн-казино Vavada https://vavada-kz-game.kz это новый адрес лучших слотов и джекпотов. Ознакомьтесь с бонусами и играйте на реальные деньги из Казахстана.
Anthonygox
Marcus Lilian Thuram-Julien https://internationale.marcus-thuram-fr.com French footballer, forward for the Internazionale club and French national team.
JosephDom
Legendary striker Cristiano Ronaldo https://an-nasr.cristiano-ronaldo-fr.com signed a contract with the Saudi club ” An-Nasr”, opening a new chapter in his illustrious career in the Middle East.
EdwardCor
Manchester City and Erling Haaland https://manchester-city.erling-haaland-fr.com explosive synergy in action. How a club and a footballer light up stadiums with their dynamic play.
WarrenLit
Lionel Messi https://inter-miami.lionel-messi-fr.com legendary Argentine footballer, announced his transfer to the American club Inter Miami.
Davidved
The official website where you can find everything about the career of Gianluigi Buffon https://gianluigi-buffon.com. Discover the story of this legendary goalkeeper who left his mark on football history and relive his achievements and unforgettable memories with us.
RockyHof
Website dedicated to football player Paul Pogba https://pogba-uz.com. Latest news from the world of football.
Jamesmax
Welcome to our official website! Go deeper into Paulo Dybala’s https://paulo-dybala.com football career. Discover Dybala’s unforgettable moments, amazing talents and fascinating journey in the world of football on this site.
PeterEmike
Latest news on the Vinicius Junior fan site https://vinisius-junior.com. Vinicius Junior has been playing since 2018 for Real Madrid (Real Madrid). He plays in the Left Winger position.
JosephNeink
Coffeeroom https://coffeeroom.by – магазин кофе, чая, кофетехники, посуды, химии и аксессуаров в Минске для дома и офиса.
ScottAnilm
Find the latest information on Khabib Nurmagomedov https://khabib-nurmagomedov.uz news and fights. Check out articles and videos detailing Khabib UFC career, interviews, wins, and biography.
Timothypaype
Latest news and information about Marcelo https://marselo-uz.com on this site! Find Marcelo’s biography, career, game stats and more.
RobertErage
Discover how Riyad Mahrez https://al-ahli.riyad-mahrez.com transformed Al-Ahli, becoming a key player and catalyst in reaching new heights in world football.
AngelstilL
Find the latest information on Conor McGregor https://conor-mcgregor.uz news, fights, and interviews. Check out detailed articles and news about McGregor’s UFC career, wins, training, and personal life.
Williamhem
Explore the dynamic world of sports https://noticias-esportivas-br.org through the lens of a sports reporter. Your source for breaking news, exclusive interviews, in-depth analysis and live coverage of all sports.
Jamesapeme
A site dedicated to Michael Jordan https://michael-jordan.uz, a basketball legend and symbol of world sports culture. Here you will find highlights, career, family and news about one of the greatest athletes of all time.
Davidkew
Get to know the history, players and latest news of the Inter Miami football club https://inter-miami.uz. Join us to learn about the successes and great performances of America’s newest and most exciting soccer club.
JorgeDweve
The latest top football news https://futebol-ao-vivo.net today. Interviews with football players, online broadcasts and match results, analytics and football forecasts
CharlesDuams
If you are a fan of UFC https://ufc-hoje.com the most famous organization in the world, come visit us. The most important news and highlights from the UFC world await you on our website.
Jimmysef
Welcome to our official website, where you will find everything about the career of Gianluigi Buffon https://gianluigi-buffon.org. Discover the story of this legendary goalkeeper who made football history.
WilliamLed
Site with the latest news, statistics, photos of Pele https://edson-arantes-do-nascimento.com and much more. Get the latest news and information about football legend Pele.
Leonardsix
The best site dedicated to the football player Paul Pogba https://pogba.org. Latest news from the world of football.
Gabrielgex
Vinicius Junior https://vinicius-junior.org all the latest current and latest news for today about the player of the 2024 season
Allenvug
Analysis of Arsenal’s impressive revival https://arsenal.bukayo-saka.biz under the leadership of Mikel Arteta and the key role of young star Bukayo Saki in the club’s return to the top.
Jesselof
Gavi’s success story https://barcelona.gavi-fr.com at Barcelona: from his debut at 16 to a key role in club and national team of Spain, his talent inspires the world of football.
GreggBiz
Pedri’s story https://barcelona.pedri-fr.com from his youth in the Canary Islands to becoming a world-class star in Barcelona, ??with international success and recognition.
Henrytroli
Discover the journey of Charles Leclerc https://ferrari.charles-leclerc-fr.com, from young Monegasque driver to Ferrari Formula 1 leader, from his early years to his main achievements within the team.
Jamesner
From childhood teams to championship victories, the path to success with the Los Angeles Lakers https://los-angeles-lakers.lebron-james-fr.com requires not only talent, but also undeniable dedication and work.
JamesDaced
Leroy Sane’s https://bavaria.leroy-sane-ft.com success story at FC Bayern Munich: from adaptation to influence on the club’s results. Inspiration for hard work and professionalism in football.
JeffreyLot
Discover the story of Rudy Gobert https://minnesota-timberwolves.rudy-gobert.biz, the French basketball player whose defensive play and leadership transformed the Minnesota Timberwolves into a powerhouse NBA team.
Rodgerinany
The story of the Moroccan footballer https://al-hilal.yassine-bounou.com, who became a star at Al-Hilal, traces his journey from the streets of Casablanca to international football stardom and his personal development.
DonaldPrier
Victor Wembanyama’s travel postcard https://san-antonio-spurs.victor-wembanyama.biz from his career in France to his impact in the NBA with the San Antonio Spurs.
AnthonyMed
The history of Michael Jordan’s Chicago Bulls https://chicago-bulls.michael-jordan-fr.com extends from his rookie in 1984 to a six-time NBA championship.
StanleyDig
Neymar https://al-hilal.neymar-fr.com at Al-Hilal: his professionalism and talent inspire young people players, taking the club to new heights in Asian football.
Zacharysmido
Golden State Warriors success story https://golden-state-warriors.stephen-curry-fr.com Stephen Curry: From becoming a leader to creating a basketball dynasty that redefined the game.
ThomasBib
Del Mar Energy is an international industrial holding company engaged in the extraction of oil, gas, and coal
BrianCrony
The success story of the French footballer https://juventus.thierry-henry.biz at Juventus: from his career at the club to leadership on the field , becoming a legend and a source of inspiration for youth.
BruceSic
The story of the great Kobe Bryant https://los-angeles-lakers.kobe-bryant-fr.com with ” Los Angeles Lakers: his path to the championship, his legendary achievements.
WilliamBialp
Novak Djokovic’s https://tennis.novak-djokovic-fr.biz journey from childhood to the top of world tennis: early years, first victories, dominance and influence on the sport.
Claudeslery
Find out the story of Jon Jones https://ufc.jon-jones-fr.biz in the UFC: his triumphs, records and controversies, which made him one of the greatest fighters in the MMA world.
HaroldFlept
Jannik Sinner https://tennis.jannik-sinner-fr.biz an Italian tennis player, went from starting his career to entering the top 10 of the ATP, demonstrating unique abilities and ambitions in world tennis.
RandyNig
Carlos Alcaraz https://tennis.carlos-alcaraz-fr.biz from a talented junior to the ATP top 10. His rise is the result of hard work, support and impressive victories at major world tournaments.
Dennykit
The fascinating story of Daniil Medvedev’s https://tennis.daniil-medvedev-fr.biz rise to world number one. Find out how a Russian tennis player quickly broke into the elite and conquered the tennis Olympus.
CarlosJop
The fascinating story of Alexander Zverev’s https://tennis.alexander-zverev-fr.biz rapid rise from a junior star to one of the leaders of modern tennis.
Thomasjax
Discover Casper Ruud’s https://tennis.casper-ruud-fr.com journey from his Challenger debut to the top 10 of the world tennis rankings. A unique success.
Diowjc
buy generic rogaine over the counter – buy minoxidil online cheap order finpecia generic
Andrehible
The powerful story of Conor McGregor’s https://ufc.conor-mcgregor-fr.biz rise to a two-division UFC championship that forever changed the landscape of mixed martial arts.
TimothyShund
The legendary boxing world champion Mike Tyson https://ufc.mike-tyson-fr.biz made an unexpected transition to the UFC in 2024, where he rose to the top, becoming the oldest heavyweight champion.
JustinZek
The fascinating story of how Lewis Hamilton https://mercedes.lewis-hamilton-fr.biz became a seven-time Formula 1 world champion after signing with Mercedes.
CharlesEdicy
The story of Fernando Alonso https://formula-1.fernando-alonso-fr.com in Formula 1: a unique path to success through talent, tenacity and strategic decisions, inspiring and exciting.
Frankhax
The fascinating story of the creation and rapid growth of Facebook https://facebook.mark-zuckerberg-fr.biz under the leadership of Mark Zuckerberg, who became one of the most influential technology entrepreneurs of our time.
Mariontruth
Kim Kardashian’s https://the-kardashians.kim-kardashian-fr.com incredible success story, from sex scandal to pop culture icon and billion-dollar fortune.
Richardwom
Max Verstappen and Red Bull Racing’s https://red-bull-racing.max-verstappen-fr.com path to success in Formula 1. A story of talent, determination and team support leading to a championship title.
RobertDAL
The astonishing story of Emmanuel Macron’s https://president-of-france.emmanuel-macron-fr.com political rise from bank director to the highest office in France.
Thomaswah
The story of Joe Biden’s https://president-of-the-usa.joe-biden-fr.com triumphant journey, overcoming many obstacles on his path to the White House and becoming the 46th President of the United States.
Erwinvam
Une ascension fulgurante au pouvoir Donald Trump https://usa.donald-trump-fr.com et son empire commercial
RobertMix
Parisian PSG https://paris.psg-fr.com is one of the most successful and ambitious football clubs in Europe. Find out how he became a global football superstar.
Matthewfed
Travel to the pinnacle of French football https://stadede-bordeaux.bordeaux-fr.org at the Stade de Bordeaux, where the passion of the game meets the grandeur of architecture.
JimmyNox
Olympique de Marseille https://liga1.marseilles-fr.com after several years in the shadows, once again becomes champion of France. How did they do it and what prospects open up for the club
LarryTuh
The fascinating story of Gigi Hadid’s rise to Victoria’s Secret Angel https://victorias-secret.gigi-hadid-fr.com status and her journey to the top of the modeling industry.
Craiglix
The fascinating story of the creation and meteoric rise of Amazon https://amazon.jeff-bezos-fr.com from its humble beginnings as an online bookstore to its dominant force in the world of e-commerce.
Danielbal
A fascinating story about how Elon Musk https://spacex.elon-musk-fr.com and his company SpaceX revolutionized space exploration, opening new horizons for humanity.
AndreGlask
The inspiring story of Travis Scott’s https://yeezus.travis-scott-fr.com rise from emerging artist to one of modern hip-hop’s brightest stars through his collaboration with Kanye West.
WilliamChusa
An exploration of Nicole Kidman’s https://watch.nicole-kidman-fr.com career, her notable roles, and her continued quest for excellence as an actress.
Marvinburry
How Taylor Swift https://midnights.taylor-swift-fr.com reinvented her sound and image on the intimate and reflective album “Midnights,” revealing new dimensions of her talent.
MitchelPet
Explore the rich history and unrivaled atmosphere of the iconic Old Trafford Stadium https://old-trafford.manchester-united-fr.com, home of one of the world’s most decorated football clubs, Manchester United.
Thomasothed
portonovi https://weather-webcam-in-montenegro.com
EddieGet
Единственная в России студия кастомных париков https://wigdealers.ru, где мастера индивидуально подбирают структуру волос и основу по форме головы, после чего стригут, окрашивают, делают укладку и доводят до идеала ваш будущий аксессуар.
BrianUnorp
The iconic Anfield https://enfield.liverpool-fr.com stadium and the passionate Liverpool fans are an integral part of English football culture.
Bobbynon
An exploration of the history of Turin’s https://turin.juventus-fr.org iconic football club – Juventus – its rivalries, success and influence on Italian football.
RobertBlels
The new Premier League https://premier-league.chelsea-fr.com season has gotten off to an intriguing start, with a new-look Chelsea looking to return to the Champions League, but serious challenges lie ahead.
Ulboub
order leflunomide sale – alfacalcidol price order cartidin pills
Matthewerupe
Tyson Fury https://wbc.tyson-fury-fr.com is the undefeated WBC world champion and reigns supreme in boxing’s heavyweight division.
MelvinThoke
Inter Miami FC https://mls.inter-miami-fr.com has become a major player in MLS thanks to its star roster, economic growth and international influence.
Derricktoica
Explore the career and significance of Monica Bellucci https://malena.monica-bellucci-fr.com in Malena (2000), which explores complex themes of beauty and human strength in wartime.
BruceNEF
Discover Rafael Nadal’s https://mls.inter-miami-fr.com impressive rise to the top of world tennis, from his debut to his career Grand Slam victory.
Anthonyguess
The story of Kanye West https://the-college-dropout.kanye-west-fr.com, starting with his debut album “The College Dropout,” which changed hip-hop and became his cultural legacy.
Gabrielwoofe
Преимущества аренды склада https://efrprograms.ru/preimushhestva-arendy-sklada-kak-arenda-skladskih-pomeshhenij-mozhet-uluchshit-vash-biznes/, как аренда складских помещений может улучшить ваш бизнес
Thomaszed
Rivaldo, or Rivaldo https://barcelona.rivaldo-br.com, is one of the greatest football players to ever play for Barcelona.
Anthonyaluri
The fascinating story of the phenomenal rise and meteoric fall of Diego Maradona https://napoli.diegomaradona.biz, who became a cult figure at Napoli in the 1980s.
JasonVuche
A fascinating story about Brazilian veteran Thiago Silva’s https://chelsea.thiago-silva.net difficult path to the top of European football as part of Chelsea London.
Rodneymuh
Explore the remarkable journey of Vinicius Junior https://real-madrid.vinicius-junior.net, the Brazilian prodigy who conquered the world’s biggest stage with his dazzling skills and unparalleled ambition at Real Madrid.
rysskoe porno hydie_cbpi
порно худых русских телок [url=https://russkie-hudyshki.ru/]russkie-hudyshki.ru[/url] .
RobertVet
Cristiano Ronaldo https://al-nassr.cristianoronaldo-br.net one of the greatest football players of all time, begins a new chapter in his career by joining An Nasr Club.
Stevenanerb
The story of Luka Modric’s rise https://real-madrid.lukamodric-br.com from young talent to one of the greatest midfielders of his generation and a key player for the Royals.
LouisLet
The fascinating story of Marcus Rashford’s rise https://manchester-united.marcusrashford-br.com from academy youth to the main striker and captain of Manchester United. Read about his meteoric rise and colorful career.
Robertloyax
From academy product to captain and leader of Real Madrid https://real-madrid.ikercasillas-br.com Casillas became one of the greatest players in the history of Real Madrid.
DonaldDient
Follow Bernardo Silva’s impressive career https://manchester-city.bernardosilva.net from his debut at Monaco to to his status as a key player and leader of Manchester City.
Williamarept
официальный сайт Rio Bet Casino официальный сайт Rio Bet Casino
TimothyAwaip
регистрация Rio Bet Casino https://dacha76.ru
JosephBon
сайт драгон мани казино официальный сайт Dragon Money
MauriceLag
официальный сайт Dragon Money реристрация Dragon Money Casino
RonnieMew
Хотите научиться готовить самые изысканные и сложные торты? В этом https://v1.skladchik.org/tags/tort/ разделе вы найдете множество подробных пошаговых рецептов самых трендовых и известных тортов с возможностью получить их за сущие копейки благодаря складчине. Готовьте с удовольствием и открывайте для себя новые рецепты вместе с Skladchik.org
ChuckLor
Лучшие пансионаты для пожилых людей https://ernst-neizvestniy.ru в Самаре – недорогие дома для престарелых в Самарской области
WilliammEf
Пансионаты для пожилых людей https://moyomesto.ru в Самаре по доступным ценам. Специальные условия по уходу, индивидуальные программы.
Jesusnuani
Ousmane Dembele’s https://paris-saint-germain.ousmanedembele-br.com rise from promising talent to key player for French football giants Paris Saint-Germain. An exciting success story.
Williamjuche
The incredible success story of 20-year-old Florian Wirtz https://bayer-04.florianwirtz-br.com, who quickly joined the Bayer team and became one of the best young talents in the world.
Donaldleano
The compelling story of Alisson Becker’s https://bayer-04.florianwirtz-br.com meteoric rise from young talent to key figure in Liverpool’s triumphant era under Jurgen Klopp.
CarlosApofs
The incredible story https://napoli.khvichakvaratskhelia-br.com of a young Georgian talent’s transformation into an Italian Serie A star. Khvicha Kvaraeshvili is a rising phenomenon in European football.
CharlesBloox
O meio-campista Rafael Veiga leva https://palmeiras.raphaelveiga-br.com o Palmeiras ao sucesso – o campeonato brasileiro e a vitoria na Copa Libertadores aos 24 anos.
JustinMum
Midfielder Rafael Veiga leads https://manchester-city.philfoden-br.com Palmeiras to success – the championship Brazilian and victory in the Copa Libertadores at the age of 24.
WilliamBrivy
In-depth articles about the most famous football players https://zenit-saint-petersburg.wendel-br.com, clubs and events. Learn everything about tactics, rules of the game and football history.
Brandonphymn
A historia da jornada triunfante de Anitta https://veneno.anitta-br.com de aspirante a cantora a uma das interpretes mais influentes da musica moderna, incluindo sua participacao na serie de TV “Veneno”.
Williamben
Fabrizio Moretti https://the-strokes.fabriziomoretti-br.com the influential drummer of The Strokes, and his unique sound revolutionized the music scene, remaining icons of modern rock.
Larrygon
Selena Gomez https://calm-down.selenagomez-br.net the story from child star to global musical influence, summarized in hit “Calm Down”, with Rema.
Bygmtj
purchase verapamil without prescription – cheap tenoretic cheap tenoretic generic
Ernestseide
Kobe Bryant https://los-angeles-lakers.kobebryant-br.net one of the greatest basketball players of all the times, left an indelible mark on the history of sport.
Gilberthax
Achraf Hakimi https://paris-saint-germain.ashrafhakimi.net is a young Moroccan footballer who quickly reached the football elite European in recent years.
DarrellVurce
Bieber’s https://baby.justinbieber-br.com path to global fame began with his breakthrough success Baby, which became his signature song and one of the most popular music videos of all time.
EddieFrifs
In the world of professional tennis, the name of Gustavo Kuerten https://roland-garros.gustavokuerten.com is closely linked to one of the most prestigious Grand Slam tournaments – Roland Garros.
MichaelTip
Ayrton Senna https://mclaren.ayrtonsenna-br.com is one of the greatest drivers in the history of Formula 1.
Iakipe
tenormin 100mg oral – buy generic tenormin buy generic carvedilol for sale
LutherPoeve
Anderson Silva https://killer-bees-muay-thai-college.andersonsilva.net was born in 1975 in Curitiba Brazil. From a young age he showed an interest in martial arts, starting to train in karate at the age of 5.
DavidFug
Daniel Alves https://paris-saint-germain.danielalves.net is a name that symbolizes the greatness of the world of football.
HerbertThexy
Bruno Miguel Borges Fernandes https://manchester-united.brunofernandes-br.com was born on September 8, 1994 in Maia, Portugal.
DwaindorgE
Rodrygo Silva de Goes https://real-madrid.rodrygo-br.com, known simply as Rodrygo, emerged as one of the the brightest young talents in world football.
JamesNab
Nuno Mendes https://paris-saint-germain.nuno-mendes.com, a talented Portuguese left-back, He quickly became one of the key figures in the Paris Saint-Germain (PSG) team.
TravisNom
Earvin “Magic” Johnson https://los-angeles-lakers.magicjohnson.biz is one of the most legendary basketball players in history. NBA history.
HowardNug
Vinicius Junior https://real-madrid.vinicius-junior-ar.com the Brazilian prodigy whose full name is Vinicius Jose Baixao de Oliveira Junior, has managed to win the hearts of millions of fans around the world in a short period of time.
Stacysom
Victor Osimhen https://napoli.victorosimhen-ar.com born on December 29, 1998 in Lagos, Nigeria, has grown from an initially humble player to one of the brightest strikers in modern football.
Leslieimarm
Toni Kroos https://real-madrid.tonikroos-ar.com the German midfielder known for his accurate passes and calmness on the field, has achieved remarkable success at one of the most prestigious football clubs in the world.
Jasonwag
Robert Lewandowski https://barcelona.robertlewandowski-ar.com is one of the most prominent footballers of our time, and his move to Barcelona has become one of the most talked about topics in world football.
Aitek_ogEn
ГК Айтек multimedijnyj-integrator.ru .
Pablogew
Pedro Gonzalez Lopez https://barcelona.pedri-ar.com known as Pedri, was born on November 25, 2002 in the small town of Tegeste, located on Tenerife, one of the Canary Islands.
Marceloboymn
The story of Leo Messi https://inter-miami.lionelmessi.ae‘s transfer to Inter Miami began long before the official announcement. Rumors about Messi’s possible departure from Barcelona appeared in 2020
GeorgeEpile
Yacine Bounou https://al-hilal.yassine-bounou-ar.com known simply as Bono, is one of the most prominent Moroccan footballers of our time.
RobertCrora
Andreson Souza Conceicao https://al-nassr.talisca-ar.com known as Talisca, is one of the brightest stars of modern football.
Jamesabuck
Harry Kane https://bayern.harry-kane-ar.com one of the most prominent English footballers of his generation, completed his move to German football club Bayern Munich in 2023.
RonaldAvess
Brazilian footballer Neymar https://al-hilal.neymar-ar.com known for his unique playing style and outstanding achievements in world football, has made a surprise move to Al Hilal Football Club.
Francisgaire
Erling Haaland https://manchester-city.erling-haaland-ar.com born on July 21, 2000 in Leeds, England, began his football journey at an early age.
StephenNob
Luka Modric https://real-madrid.lukamodric-ar.com can certainly be called one of the outstanding midfielders in modern football.
Richardtrips
Football in Saudi Arabia https://al-hilal.ali-al-bulaihi-ar.com has long been one of the main sports, attracting millions of fans. In recent years, one of the brightest stars in Saudi football has been Ali Al-Bulaihi, defender of Al-Hilal Football Club.
Scottzex
visit my website https://currencyconvert.net
Samuelbit
Сайт https://ps-likers.ru предлагает уроки по фотошоп для начинающих. На страницах сайта можно найти пошаговые руководства по анимации, созданию графики для сайтов, дизайну, работе с текстом и фотографиями, а также различные эффекты.
Williamfap
N’Golo Kante https://al-ittihad.ngolokante-ar.com the French midfielder whose career has embodied perseverance, hard work and skill, has continued his path to success at Al-Ittihad Football Club, based in Saudi Arabia.
CharlespYdaY
Kobe Bryant https://los-angeles-lakers.kobebryant-ar.com also known as the “Black Mamba”, is one of the most iconic and iconic figures in NBA history.
Wfiqbi
atorvastatin drug – order lisinopril online cheap bystolic buy online
JeffreyLiedo
RDBox.de https://rdbox.de bietet schallgedammte Gehause fur 3D-Drucker, die eine sehr leise Druckumgebung schaffen – nicht lauter als ein Kuhlschrank. Unsere Losungen sorgen fur stabile Drucktemperatur, Vibrationsisolierung, Luftreinigung und mobile App-Steuerung.
RogerMaick
Cristiano Ronaldo https://al-nassr.cristiano-ronaldo.ae is one of the greatest names in football history, with his achievements inspiring millions of fans around the world.
WalterPoold
In 2018, the basketball world witnessed one of the most remarkable transformations in NBA history. LeBron James https://los-angeles-lakers.lebronjames-ar.com one of the greatest players of our time, decided to leave his hometown Cleveland Cavaliers and join the Los Angeles Lakers.
Chrispriva
Luis Diaz https://liverpool.luis-diaz-ar.com is a young Colombian striker who has enjoyed rapid growth since joining the ” Liverpool” in January 2022.
WesleyNef
Kevin De Bruyne https://manchester-city.kevin-de-bruyne-ar.com is a name every football fan knows today.
GeorgeSlupe
Muhammad Al Owais https://al-hilal.mohammed-alowais-ar.com is one of the most prominent names in modern Saudi football. His path to success in Al Hilal team became an example for many young athletes.
Videosteni v Moskve_dzMl
видеостена цена видеостена цена .
Robertzem
Maria Sharapova https://tennis.maria-sharapova-ar.com was born on April 19, 1987 in Nyagan, Russia. When Masha was 7 years old, her family moved to Florida, where she started playing tennis.
Johnniebop
Roberto Firmino https://al-ahli.roberto-firmino-ar.com one of the most talented and famous Brazilian footballers of our time, has paved his way to success in different leagues and teams.
Philliphalse
Angel Di Maria https://benfica.angel-di-maria-ar.com is a name that will forever remain in the memories of Benfica fans.
Westonskype
Khvicha Kvaratskhelia https://napoli.khvicha-kvaratskhelia-ar.com is a name that in recent years has become a symbol of Georgian football talent and ambition.
Andrewesee
Football in Saudi Arabia https://al-hilal.saud-abdulhamid-ar.com is gaining more and more popularity and recognition on the international stage, and Saud Abdul Hamid, the young and talented defender of Al Hilal, is a shining example of this success.
Peterkab
Казахский национальный технический университет https://satbayev.university им. К.Сатпаева
Shaunfah
Upcoming fantasy MOBA https://bladesofthevoid.com evolved by Web3. Gacha perks, AI and crafting in one swirling solution!
Kevinleams
Продажа новых автомобилей Hongqi
https://hongqi-krasnoyarsk.ru/politics в Красноярске у официального дилера Хончи. Весь модельный ряд, все комплектации, выгодные цены, кредит, лизинг, трейд-ин
Davidloove
Kylie Jenner https://kylie-cosmetics.kylie-jenner-ar.com is an American model, media personality, and businesswoman, born on August 10, 1997 in Los Angeles, California.
affordable large format printing bundaberg
I am usually impressed by the quality of your writing. You do have a actual gift for communicating elaborate Suggestions in a method that is quick to understand.
Slgvkc
brand gasex – buy diabecon sale where to buy diabecon without a prescription
Edwardmop
https://canadapharmast.com/# canadian drug
Michaelhig
п»їlegitimate online pharmacies india: indian pharmacy paypal – cheapest online pharmacy india
Charleskep
indian pharmacy online Online medicine home delivery indian pharmacy
Richardwefly
Bella Hadid https://img-models.bella-hadid-ar.com is an American model who has emerged in recent years as one of the most influential figures in the world of fashion.
Jasonziz
Sadio Mane https://al-nassr.sadio-mane-ar.com the Senegalese footballer best known for his performances at clubs such as Southampton and Liverpool, has become a prominent figure in Al Nassr.
Dannydiano
Brazilian footballer Ricardo Escarson https://orlando-city.kaka-ar.com dos Santos Leite, better known as Kaka, is one of the most famous and successful players in football history.
Michaelhig
medicine in mexico pharmacies: buying prescription drugs in mexico online – medicine in mexico pharmacies
Louisenhah
Edson Arantes https://santos.pele-ar.com do Nascimento, known as Pele, was born on October 23, 1940 in Tres Coracoes, Minas Gerais, Brazil.
TyroneduB
Monica Bellucci https://dracula.monica-bellucci-ar.com one of the most famous Italian actresses of our time, has a distinguished artistic career spanning many decades. Her talent, charisma, and stunning beauty made her an icon of world cinema.
Edwardmop
https://foruspharma.com/# pharmacies in mexico that ship to usa
Ozvychivanie pomeshenii_axOa
услуги озвучивания ozvuchivanie-pomeshhenij.ru .
Charleskep
certified canadian international pharmacy canada drugs reviews www canadianonlinepharmacy
BrianBoinc
Brazilian footballer Malcom https://al-hilal.malcom-ar.com (full name Malcom Felipe Silva de Oliveira) achieved great success in Al Hilal, one of the leading football teams in Saudi Arabia and the entire Middle East.
AndrewCaurb
Jackie Chan https://karate-kid.jackiechan-ar.com was born in 1954 in Hong Kong under the name Chan Kong San.
Michaelhig
mexican mail order pharmacies: mexican border pharmacies shipping to usa – purple pharmacy mexico price list
magazin akkayntov_dtel
магазин аккаунтов wot blitz магазин аккаунтов wot blitz .
Charleskep
reputable indian online pharmacy best online pharmacy india india pharmacy mail order
Edwardmop
http://foruspharma.com/# mexican online pharmacies prescription drugs
Michaelhig
mexican mail order pharmacies: buying prescription drugs in mexico – best online pharmacies in mexico
Ivjywc
order lasuna without prescription – himcolin medication himcolin brand
Weed Delivery Queens
Excellent read, I just passed this onto a colleague who was doing a little research on that. And he actually bought me lunch because I found it for him smile So let me rephrase that.|
Jamesapacy
Travis Scott https://astroworld.travis-scott-ar.com is one of the brightest stars in the modern hip-hop industry.
DonaldGex
Zinedine Zidane https://real-madrid.zinedine-zidane-ar.com the legendary French footballer, entered the annals of football history as a player and coach.
WilliamErums
The history of one of France’s https://france.paris-saint-germain-ar.com most famous football clubs, Paris Saint-Germain, began in 1970, when capitalist businessmen Henri Delaunay and Jean-Auguste Delbave founded the club in the Paris Saint-Germain-en-Laye area.
CalvinDiuff
Juventus Football Club https://italy.juventus-ar.com is one of the most successful and decorated clubs in the history of Italian and world football.
lychshee besplatnoe porno_uapt
смотреть лучшее порно бесплатно без регистрации смотреть лучшее порно бесплатно без регистрации .
Raymondhitle
Автомобили Hongqi https://hongqi-krasnoyarsk.ru в наличии – официальный дилер Hongqi Красноярск
Matthewkem
Liverpool https://england.liverpool-ar.com holds a special place in the history of football in England.
Kennethkes
When Taylor Swift https://shake-it-off.taylor-swift-ar.com released “Shake It Off” in 2014, she had no idea how much the song would impact her life and music career.
RobertWot
Priyanka Chopra https://baywatch.priyankachopra-ar.com is an Indian actress, singer, film producer and model who has achieved global success.
RobertThuro
Jennifer Lopez https://lets-get-loud.jenniferlopez-ar.com was born in 1969 in the Bronx, New York, to parents who were Puerto Rican immigrants.
porno ioga_dskt
смотреть порно занимаются йогой http://www.yoga-porno.ru .
Christop
After some difficult years in the late 2010s, Manchester United https://england.manchester-united-ar.com returned to greatness in English football by 2024.
EdwinElumb
The Formula One World Championship https://world-circuit-racing-championship.formula-1-ar.com, known as the Formula Championship in motor racing, is the highest tier of professional motor racing.
BryanClefe
Michael Jordan https://chicago-bulls.michael-jordan-ar.com is one of the greatest basketball players of all time, whose career with the Chicago Bulls is legendary.
StevenExank
дизайн интерьера онлайн дизайн интерьера зала
lychshee porevo_ucOi
лучшее порно порево besplatny-sex-online.ru .
WilliamWrilm
rent a car in Montenegro airport renting a car in Montenegro
Herbertnop
Muhammad Ali https://american-boxer.muhammad-ali-ar.com is perhaps one of the most famous and greatest athletes in the history of boxing.
JeffreyThity
Manny Pacquiao https://filipino-boxer.manny-pacquiao-ar.com is one of the most prominent boxers in the history of the sport.
Keithglige
Mike Tyson https://american-boxer.mike-tyson-ar.com one of the most famous and influential boxers in history, was born on June 30, 1966 in Brooklyn, New York.
GeorgeFrown
The golf https://arabic.golfclub-ar.com industry in the Arab world is growing rapidly, attracting players from all over the world.
Jameslab
paxlovid generic: paxlovid for sale – Paxlovid over the counter
Donaldrap
The road to the Premier League https://english-championship.premier-league-ar.com begins long before a team gets promoted to the English Premier League for the first time
Davidrer
The Italian football championship https://italian-championship.serie-a-ar.com known as Serie A, has seen an impressive revival in recent years.
Bretttes
In the German football https://german-championship.bundesliga-football-ar.com championship known as the Bundesliga, rivalries between clubs have always been intense.
RobertBleli
In recent years, the leading positions in the Spanish https://spanish-championship.laliga-ar.com championship have been firmly occupied by two major giants – Barcelona and Real Madrid.
Kennethchoky
EuroAvia24.com – Cheap flights, hotels and transfers around the world!
MartinJap
In an era when many young footballers struggle to find their place at elite clubs, Javi’s https://barcelona.gavi-ar.com story at Barcelona stands out as an exceptional one.
IsaiasBut
Rodrigo Goes https://real-madrid.rodrygo-ar.com better known as Rodrigo, is one of the brightest young talents in modern football.
Oscarvib
Arsenal https://arsenal.mesut-ozil-ar.com made a high-profile signing in 2013, signing star midfielder Mesut Ozil from Real Madrid.
DavidRerse
Thibaut Courtois https://real-madrid.thibaut-courtois-ar.com was born on May 11, 1992 in Belgium.
VictorLoawl
Bayern Munich’s https://bayern.jamal-musiala-ar.com young midfielder, Jamal Musiala, has become one of the brightest talents in European football.
Larrymon
грузовой подъемник четырехстоечный https://podemniki-gruzovye.ru
Jameslab
amoxicillin generic: amoxicillin brand name – amoxicillin from canada
Frankerepe
Luis Suarez https://inter-miami.luis-suarez-ar.com the famous Uruguayan footballer, ended his brilliant career in European clubs and decided to try his hand at a new challenge – Major League Soccer.
Brianswolo
Al-Nasr https://saudi.al-nassr-ar.com is one of the most famous football teams in the Kingdom of Saudi Arabia.
MichaelBal
Al-Ittihad https://saudi.al-ittihad-ar.com is one of the most famous football clubs in Saudi Arabia. Founded in 1927, the Saudi football giant has come a long way to the pinnacle of success.
JosephcoF
Al-Nasr Club https://saudi.al-hilal-ar.com from Riyadh has a rich history of success, but its growth has been particularly impressive in recent years.
ThomasErert
https://amoxildelivery.pro/# buy cheap amoxicillin
Keithfam
FC Barcelona https://spain.fc-barcelona-ar.com is undoubtedly one of the most famous and well-known football clubs in the world.
Lisddq
buy noroxin generic – buy flutamide medication where to buy confido without a prescription
CarrollPsype
azimut magellano 53 https://boat-hire-in-montenegro.com
Mariontuh
boat hire Kotor Montenegro rent boat
RandallNIC
Arsenal https://england.arsenal-ar.com is one of the most famous and successful football clubs in the history of English football.
TimothyDinia
Real Madrid’s https://spain.real-madrid-ar.com history goes back more than a century. The club was founded in 1902 by a group of football enthusiasts led by Juan Padilla
MichaelNus
FC Bayern Munich (Munich) https://germany.bayern-munchen-ar.com is one of the most famous and recognized football clubs in Germany and Europe
Thomasviz
типография телефон https://salavat-rik.ru
CharlesLiaks
Ремонт плоской кровли https://remontiruem-krovly.ru в Москве, цена работы за 1 м?. Прайс лист на работы под ключ, отзывы и фото.
Michaelsef
AC Milan https://italy.milan-ar.com is one of the most successful and decorated football clubs in the world.
GeorgeChelf
In the world of football, Atletico Madrid https://spain.atletico-madrid-ar.com has long been considered the second most important club in Spain after the dominant, Real Madrid.
JamesVal
Galatasaray https://turkey.galatasaray-ar.com is one of the most famous football clubs in Turkiye, with a glorious and eventful history.
DavidCom
The future football star Shabab Al-Ahly https://dubai.shabab-al-ahli-ar.com was born in Dubai in 2000. From a young age, he showed exceptional football abilities and joined the youth academy of one of the UAE’s leading clubs, Shabab Al-Ahly.
Michaelirrab
The fascinating story of Ja Morant’s https://spain.atletico-madrid-ar.com meteoric rise, from status from rookie to leader of the Memphis Grizzlies and rising NBA superstar.
Timothyhoaft
купить квартиру недорого недвижимость купить квартиру
TerryJaire
купить двухкомнатную квартиру купить новостройку цены застройщика
GregoryLow
https://indibeti.in is a premier online casino offering a wide array of games including slots, table games, and live dealer options. Renowned for its user-friendly interface and robust security measures, Indibet ensures a top-notch gaming experience with exciting bonuses and 24/7 customer support.
RobertSit
квартиры от застройщика цены жк купить новостройку с отделкой
JasonSCeft
купить новостройку недорого https://kvartirukupit43.ru
JamesClula
недвижимость купить квартиру https://novye-kvartiryspb.ru
WilliamhiC
купить 1 комнатную квартиру в новостройке https://newkvartiry-spb.ru
ThomasSorce
квартиры от застройщика цены жк https://novye-kvartiry-spb.ru
Matthewabews
купить новостройку от застройщика https://novyekvartiry2.ru
Allenjuddy
купить квартиру новостройка застройщика отделкой https://zastroyshikekb54.ru
DanielHab
квартиры от застройщика https://zastroyshikekb.ru
WilliamIrrip
квартиру новостройку жк купить https://kvartiranovostroi.ru
Tommiesep
квартиры от застройщика цены жк https://kvartira-novostroi.ru
RaymondAdace
купить 1 квартиру в новостройке купить новостройку цены застройщика
ThomasNoF
Помощь в решении задач https://zadachireshaem-online.ru. Опытные авторы с профессиональной подготовкой окажут консультацию в решении задач на заказ недорого, быстро, качественно
RogerDriny
купить квартиру в новостройке цены https://kvartira-novostroyka2.ru
Johnnytob
Заказать контрольную работу https://kontrolnye-reshim.ru, недорого, цены. Решение контрольных работ на заказ срочно.
menang judi slot
Good site! I truly love how it is easy on my eyes it is. I am wondering how I might be notified when a new post has been made. I’ve subscribed to your RSS which may do the trick? Have a great day!
Charlesvom
Заказать курсовую работу https://kursovye-napishem.ru в Москве: цены на написание и выполнение, недорого
DavidDal
Заказать дипломную работу https://diplomzakazat-oline.ru недорого. Дипломные работы на заказ с гарантией.
Arthurnog
Accessibility Team Meeting Notes https://make.wordpress.org/accessibility/2021/06/11/accessibility-team-meeting-notes-june-11-2021
Richarddon
Красивая музыка https://melodia.space для души слушать онлайн.
Stephenveido
Помощь студентам в выполнении рефератов https://referatkupit-oline.ru. Низкие цены и быстрое написание рефератов!
Danielscase
seo казань оптимизация и seo продвижение сайтов
StevenDuh
seo продвижение сайта услуги https://seo-raskrutka43.ru
Williamdab
компания продвижение https://seooptimizatsia.ru
Brandontak
заказать продвижение корпоративного сайта https://seo-optimizatsia.ru
JamesMak
Останні новини України https://gromrady.org.ua сьогодні онлайн – головні події світу
HarryDat
Новинний ресурс https://actualnews.kyiv.ua про всі важливі події в Україні та світі.
RobertGuete
Новини сьогодні https://gau.org.ua останні новини України та світу онлайн
EddieMib
Новини України https://kiev-online.com.ua останні події в Україні та світі сьогодні, новини України за минулий день онлайн
StephenZotte
Популярные репортажи https://infotolium.com в больших фотографиях, новости, события в мире
KennethObjew
Україна свіжі новини https://kiev-pravda.kiev.ua останні події на сьогодні
DavidTaive
Свіжі новини України https://lenta.kyiv.ua останні новини з-за кордону, новини політики, економіки, спорту, культури.
JoshuaAvaby
Україна останні новини https://lentanews.kyiv.ua головні новини та останні події
digital landscape finding
You are good writer. Thank you.
DerekUnres
Новини та аналітика https://newsportal.kyiv.ua ситуація в Україні.
Jeromesom
Головні новини https://mediashare.com.ua про регіон України. Будьте в курсі останніх новин
Shawnsmono
Новини України https://sensus.org.ua та світу сьогодні. Головні та останні новини дня
Richardabame
Головні новини https://pto-kyiv.com.ua України та світу
Henryliz
Новини, останні події https://prp.org.ua в Україні та світі, новини політики, бізнесу та економіки, законодавства
KevinJeamy
Корисні та цікаві статті https://sevsovet.com.ua про здоров’я, дозвілля, кар’єру.
Daviddug
Головні новини https://status.net.ua сьогодні, найсвіжіші та останні новини України онлайн
Terrymat
Останні новини https://thingshistory.com зовнішньої та внутрішньої політики в країні та світі.
Danielwak
Останні новини світу https://uamc.com.ua про Україну від порталу новин Ukraine Today
Oborydovanie aktovih zalov_eyea
световое оборудование для актового зала http://www.oborudovanija-dlja-aktovyh-zalov.ru/ .