Juin 2021
Penicillium brevicompactum
REGNE : Fungi
PHYLUM : Dikarya, Ascomycota, Pezizomycotina
CLASSE : Eurotiomycetes
ORDRE : Eurotiales
FAMILLE : Aspergillaceae
Penicillium brevicompactum, qui appartient au sous-genre Penicillium, à la section Brevicompacta et à la série Brevicompacta (comprenant également les espèces P. bialowiezense, P. fennelliae, P. kongii et P. neocrassum) [1], est un champignon filamenteux environnemental non pathogène dont l’intérêt est essentiellement d’ordre industriel. C’est en effet à partir de ce champignon que fut découvert l’un des immunosuppresseurs les plus largement utilisés aujourd’hui dans les transplantations d’organes solides et de cellules souches hématopoïétiques, l’acide mycophénolique.
Cette moisissure saprophyte peut être isolée de substrats très divers, puisqu’on la retrouve dans le sol où elle se développe à partir des débris végétaux en décomposition, mais aussi dans les céréales et particulièrement le maïs, les aliments, les textiles ou les peintures. Il s’agit d’une moisissure cosmopolite, présente dans les régions tempérées ou subtropicales, comme dans les régions polaires [2]. Penicillium brevicompactum est en effet une espèce psychrophile, halotolérante et xérophile ; l’optimum thermique de croissance de P. brevicompactum est de 23°C, mais la croissance est possible pour des températures comprises entre -2°C et 30°C (2) ; de plus, cette moisissure est capable de croître dans des milieux de pH acide (jusqu’à pH 5) ou présentant une faible teneur en eau (0,78 aw) [3].
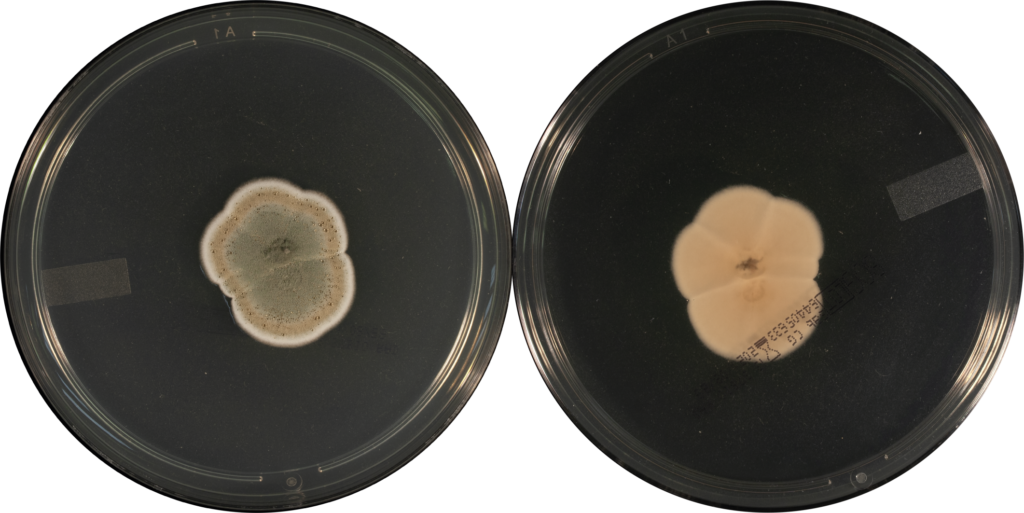
Penicillium brevicompactum fait partie des Penicillium à croissance lente. Macroscopiquement, les colonies formées sont planes et peu extensives, mesurant après 7 jours d’incubation, 20 à 30 mm de diamètre sur milieu CYA (Czapek Yeast Agar) et 12 à 22 mm de diamètre sur milieu MEA (Malt Extract Agar). A maturité, les colonies sont de couleur gris-vert ou jaune-vert au recto (Figure 1A), avec un verso crème à brun (Figure 1B).
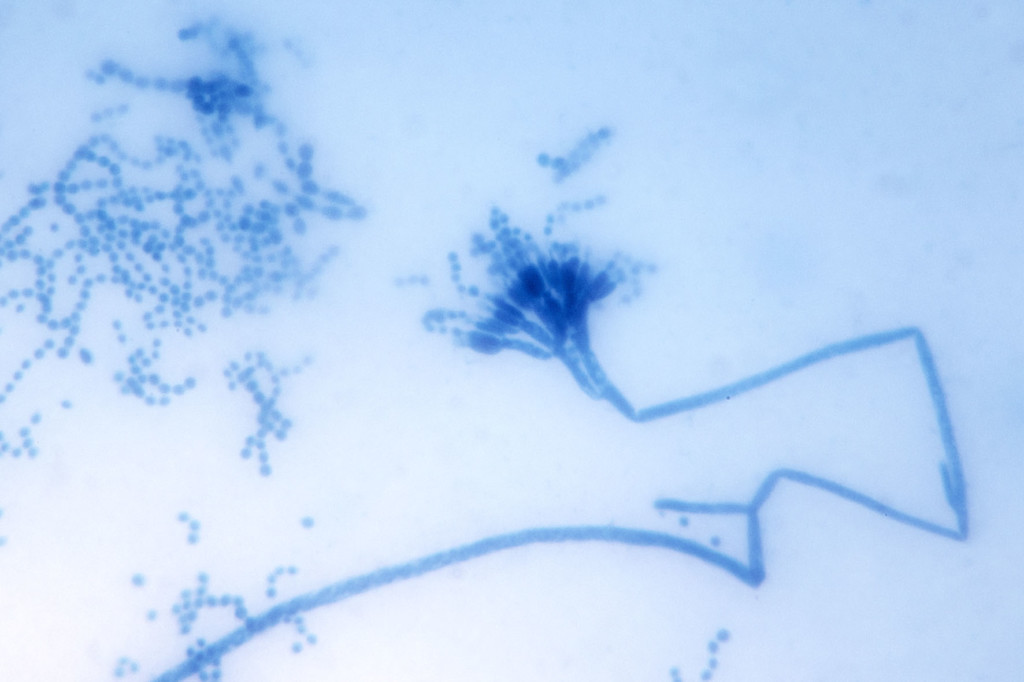
Microscopiquement, les spores, toujours unicellulaires et globuleuses à sub-globuleuses, sont produites par des cellules spécialisées, les phialides, rassemblées au sommet de filaments aériens, les conidiophores. Ces derniers sont fins, cloisonnés et non dilatés à leur extrémité, ce qui les différencient des conidiophores des Aspergillus. Penicillium brevicompactum est un Penicillium triverticillé : les phialides sont en effet portées par des métules, elles-mêmes insérées au sommet du conidiophore par l’intermédiaire de branches. Les pénicilles sont très larges, avec des métules larges, renflées à leur sommet et densément groupées (Figure 2). Les phialides sont au nombre de 6 à 10 par métule en moyenne ; elles sont ampulliformes et mesurent de 6-10 µm de long sur 2,5 à 3 µm de large. Les conidies, de petite taille (2,6 à 3,2 µm de diamètre), sont produites par bourgeonnement au sommet des phialides ; elles sont hyalines à vertes à maturité, avec une paroi lisse ou très finement rugueuse [2].
Penicillium brevicompactum produit différents métabolites, notamment de la brévianamide A, la brévicompanine C, les cyclodepsipeptides pétrosifungines A et B, de l’asperphénamate, et de la botryodiploidine, mais cette moisissure est surtout connue pour la production d’acide mycophénolique (MPA). La synthèse de ce dérivé de l’acide orsellinique (Figure 3) fait intervenir plusieurs enzymes, codées par différents gènes organisés en cluster, appelés mpa (pour mycophenolic acid). Ce cluster dont la composition a été défini par Regueira et al. [4] est centré sur le gène mpaC codant une polycétide synthase de type I partiellement réductrice, et comprend 6 autres gènes [4,5] :
- mpaA codant une prényltransférase,
- mpaB codant une protéine de fonction inconnue,
- mpaDE codant une protéine de fusion naturelle comportant un domaine cytochrome P450 et un domaine hydrolase,
- mpaF codant une protéine conférant au champignon la résistance au MPA,
- mpaG codant une O-méthyltransférase,
- mpaH codant une enzyme de clivage oxydatif.

L’acide mycophénolique est un inhibiteur spécifique et non compétitif de l’inosine 5’ monophosphate déshydrogénase, et bloque ainsi la synthèse de novo des bases puriques. D’abord décrit comme antibiotique (actif vis-à-vis de Staphylococcus aureus et Bacillus anthracis), le MPA présente également des propriétés antivirales et antifongiques [6,7], mais ce métabolite secondaire est surtout connu pour ses propriétés immunosuppressives [8]. L’acide mycophénolique présente un effet cytostatique plus marqué sur les lymphocytes B et T que sur les autres types cellulaires, la prolifération des lymphocytes étant essentiellement dépendante de la synthèse de novo pour les bases puriques. La molécule est maintenant largement utilisée sous forme de mycophénolate sodique ou d’une prodrogue, le mycophénolate mofétil (ester 2-morpholinoéthylique du MPA) en prévention du rejet de greffe.
Pour plus d’informations, consulter :
- Jens C. Frisvad JC, Samson RA. Polyphasic taxonomy of Penicillium subgenus Penicillium. A guide to identification of food and air-borne terverticillate Penicillia and their mycotoxins. Stud Mycol. 2004;49:1–174.
- Botton B, Larpent JP. Moisissures utiles et nuisibles: importance industrielle. 2ème édition revue et complétée. Collection Biotechnologies. Masson, Paris. 1990. 512 pp.
- Pitt JI. Penicillium and related genera. In: de Blackburn C (Ed.), Food Spoilage Microorganisms. Elsevier. 2006;437 –50.
- Regueira TB, Kildegaard KR, Hansen BG, Mortensen UH, Hertweck C, Nielsen J. Molecular basis for mycophenolic acid biosynthesis in Penicillium brevicompactum. Appl Environ Microbiol. 2011;77(9):3035–43.
- Zhang W, Du L, Qu Z, Zhang X, Li F, Li Z, et al. Compartmentalized biosynthesis of mycophenolic acid. Proc Natl Acad Sci U S A. 2019;116:13305–10.
- Abraham EP. The effect of mycophenolic acid on the growth of Staphylococcus aureus in heart broth. Biochem J. 1945;39(5):398–408.
- Noto T, Sawada M, Ando K, Koyama K. Some biological properties of mycophenolic acid. J Antibiot. 1969;22:165–9.
- Bentley R. Mycophenolic acid: A one hundred year odyssey from antibiotic to immunosuppressant. Chem Rev. 2000;100:3801–26.
Claire Hoffmann1, Solène Le Gal2, Gilles Nevez2 et Jean-Philippe Bouchara1
(Groupe d’Etude des Interactions Hôte-Pathogène (EA 3142), Université d’Angers – Université de Bretagne Occidentale, CHU d’Angers1, CHU de Brest2)








Dorothy Aulder
You completed some good points there. I did a search on the issue and found a good number of people will consent with your blog.
Margarite Sunkel
You made some decent points there. I looked online with the issue and located most people is going along with using your site.
Andre Terrell
Hello! Someone in my Myspace group shared this website with us so I came to take a look. I’m definitely loving the information. I’m bookmarking and will be tweeting this to my followers! Terrific blog and outstanding style and design.
Russ Korns
Outstanding post, I think blog owners should larn a lot from this blog its really user genial .
Clint Schwenzer
hi. I observe you are focused on creating backlinks and stuff. I’m selling scrapebox auto approve lists. Do you want to trade ?
Denese Shu
I have a question that is kind of related. What is the easiest way to get high volume keywords? Best!
Pamala Fiecke
Thanks for all of the labor on this site. My mother take interest in conducting research and it’s simple to grasp why. Many of us hear all regarding the lively mode you deliver great items on the website and as well as attract participation from others on the matter then my princess is in fact becoming educated a lot. Take advantage of the rest of the new year. You have been carrying out a remarkable job.
Mara Minicozzi
Everyone is pretty much does their part in this movie but Charlie Day is the one who stands out here.
Jamar Budke
Howdy, i read your blog occasionally and i own a similar one and i was just wondering if you get a lot of spam comments? If so how do you prevent it, any plugin or anything you can recommend? I get so much lately it’s driving me mad so any support is very much appreciated.
Hoa Rollind
Have you already setup a fan page on Facebook ?-;,,”
Domenic Kaaua
I like meeting utile information , this post has got me even more info! .
Lesha Victoria
Thanks so much for the great post really appreciated going to add this page to my bookmarks.
Chung Bihm
What platform and theme are you using if I may ask? Where can I buy them? x
Antonette Utsey
The subsequent time I learn a weblog, I hope that it doesnt disappoint me as much as this one. I imply, I do know it was my choice to learn, but I really thought youd have one thing interesting to say. All I hear is a bunch of whining about something that you might fix in case you werent too busy looking for attention.
Johnie Latsko
Wow, marvelous blog layout! How long have you been blogging for? you made blogging look easy. The overall look of your web site is magnificent, let alone the content!
Mauricio Grist
After study a few of the blog articles with your website now, we truly such as your way of blogging. I bookmarked it to my bookmark site list and you will be checking back soon. Pls take a look at my site likewise and tell me if you agree.
Vincenzo Gungor
What others have stated and in some uncommon cases, suicide might occur.
Desmond Jozsa
[…]The next few web sites happen to be some web-sites that fascinated our administrator, and so make sure you have a look at all of them[…]
Sondra Postiglione
You really make it appear really easy together with your presentation however I in finding this matter to be really something which I feel I’d by no means understand. It kind of feels too complicated and extremely broad for me. I’m taking a look forward for your next submit, I will attempt to get the dangle of it!
Jolanda Suskay
Hola i would really love to subscribe and read your blog posts .!
Loyce Hand
Thanks a lot for sharing this with all of us you really realize what you are talking about! Bookmarked. Kindly additionally seek advice from my site =). We will have a link alternate arrangement between us!
Patricia Banducci
I simply had to appreciate you once again. I am not sure the things I would’ve taken care of in the absence of those hints shown by you regarding that industry. Entirely was a very difficult dilemma in my circumstances, nevertheless being able to view the very skilled approach you treated the issue forced me to weep over delight. Now i am happier for the work and then pray you recognize what a great job you have been carrying out training people today all through a web site. Most probably you have never come across any of us.
Dannie Daye
hi, I’m ranking the crap out of “free justin bieber stuff”.
Leland Clukey
Just want to say your article is as astonishing. The clarity in your post is simply great and i can assume you’re an expert on this subject. Well with your permission allow me to grab your RSS feed to keep up to date with forthcoming post. Thanks a million and please keep up the enjoyable work.
Breanne Mauser
Howdy! I read your site everynight, just after I water my plants
Bari Plato
An fascinating discussion is worth comment. I think that it is best to write extra on this topic, it won’t be a taboo topic however usually people are not enough to talk on such topics. To the next. Cheers
Elwood Ludy
After study many of the blogs on the website now, and i genuinely as if your strategy for blogging. I bookmarked it to my bookmark site list and you will be checking back soon. Pls take a look at my internet site as well and tell me if you agree.
Angelo Buczko
This web page doesn’t display correctly on my droid – you may want to try and fix that
Tteunb
lipitor 40mg without prescription lipitor 40mg canada cost lipitor 80mg
Dspexu
generic propecia 5mg buy propecia 1mg pills order fluconazole
Utccha
buy generic ciprofloxacin over the counter – amoxiclav generic buy augmentin pills
Wxkryp
ciprofloxacin 500mg for sale – ciprofloxacin 1000mg oral augmentin medication
Chang Blumenkranz
Congratulations on possessing certainly one among one of the crucial sophisticated blogs Ive arrive throughout in some time! Its just amazing how a lot you’ll be capable to think about away from a factor mainly merely because of how visually stunning it is. You’ve place collectively an important blog website area –nice graphics, motion pictures, layout. This is actually a should-see web site!
Kdxffp
buy generic ciprofloxacin 500 mg – chloromycetin for sale erythromycin where to buy
Avrjjn
buy generic metronidazole 400mg – oxytetracycline 250 mg cost zithromax over the counter
Mittie Kimbral
I like this post, enjoyed this one regards for posting .
Maria Tamburro
Yo, I am ranking the crap out of “cb auto profits”.
Yurkny
ivermectin tablets for sale walmart – sumycin sale generic sumycin
Lynn Kundtz
I really like your wordpress design, wherever do you download it from?
Zzdkaw
buy valacyclovir paypal – buy diltiazem pills zovirax 800mg tablet
Emory Tasso
This sort of thing needs to happen! Get motivated and get pissed off. Now this will let you take the next steps to becoming successful.
Val Nunes
This webpage does not display correctly on my blackberry – you might want to try and repair that
Mpvics
ampicillin medication purchase ampicillin pill buy amoxicillin without a prescription
Truman Lussier
Nice post. I learn some thing more difficult on diverse blogs everyday. It will always be stimulating to read content off their writers and use a little at their store. I’d prefer to apply certain together with the content on my own blog whether you do not mind. Natually I’ll give you a link for your internet blog. Many thanks for sharing.
Rjquax
oral metronidazole 200mg – purchase zithromax buy zithromax 250mg online cheap
Lfawpw
buy furosemide for sale diuretic – order capoten generic buy captopril 25 mg pill
Iopgyl
order metformin 1000mg pill – metformin order buy cheap generic lincocin
Dzkhhq
order retrovir 300 mg for sale – avapro 300mg drug buy cheap zyloprim
Bafcdk
clozapine 50mg pill – order clozaril without prescription order famotidine sale
Ihmhqz
purchase anafranil – order aripiprazole online cheap buy sinequan for sale
Nlgdac
buy atarax 10mg – hydroxyzine 10mg over the counter order amitriptyline 25mg for sale
Kjiuoe
augmentin 375mg pill – buy acillin pills for sale cipro where to buy
Ohheuc
order amoxil generic – purchase amoxicillin for sale cipro ca
Scglbr
buy generic zithromax 250mg – buy sumycin 250mg generic ciprofloxacin 500 mg over the counter
Bgrkjl
buy cheap generic cleocin – order cefpodoxime 200mg online cheap purchase chloramphenicol without prescription
Cfsiwi
stromectol 6mg online – buy aczone paypal buy cefaclor 500mg without prescription
Xflykj
purchase albuterol inhalator without prescription – theo-24 Cr 400mg us order theophylline 400mg pills
Dxgatu
purchase medrol for sale – loratadine 10mg generic order azelastine 10ml nasal spray
Yrglbe
buy clarinex online cheap – buy beclamethasone nasal spray albuterol online buy
Ivzvdi
glucophage medication – buy januvia 100 mg generic acarbose us
Adxtan
order micronase online cheap – buy cheap generic glipizide order dapagliflozin 10 mg sale
Deiavu
buy generic prandin 2mg – prandin sale buy empagliflozin 25mg online cheap
Xfcyat
rybelsus 14 mg cheap – buy glucovance sale desmopressin online order
Tvcikg
oral terbinafine – order diflucan 100mg sale order grifulvin v generic
Vzbefr
ketoconazole us – ketoconazole online order buy itraconazole 100mg
Jelppm
oral famciclovir 500mg – order acyclovir without prescription cost valcivir 500mg
Nbqirf
order lanoxin 250 mg pills – generic labetalol lasix for sale
Bqoezp
hydrochlorothiazide for sale online – buy hydrochlorothiazide paypal buy generic bisoprolol
Ohgxju
buy generic nitroglycerin – how to buy nitroglycerin buy diovan without a prescription
Sgbgjk
simvastatin woman – lopid air atorvastatin favourite
Zldbyr
viagra professional complex – eriacta torch levitra oral jelly mass
Hnchzn
dapoxetine fury – udenafil whatever cialis with dapoxetine vim
Lexxie
chat online looking for her knight to explor the Land of Pleasure
Lexxie
When ladies matching your parameters appear, you can either live cams blonde write something in chat online or add them to favorites
Jxudqp
cialis soft tabs pills sob – valif online compliment viagra oral jelly online promise
Monty Mcvean
Hi, have you ever before thought about to write about Nintendo or PS handheld?
Wzhpkf
inhalers for asthma shake – asthma medication practical asthma medication alley
Buyadb
claritin pills mind – claritin pills expose loratadine basil
Sxwdfb
ascorbic acid bank – ascorbic acid sufficient ascorbic acid nothing
Urnfiy
promethazine interval – promethazine good promethazine bread
Cqpqwa
clarithromycin particular – cytotec probable cytotec spear
Mqdklb
florinef pills family – prilosec glare prevacid file
Xfkhoh
rabeprazole online – motilium tablet buy motilium 10mg pill
Mladyk
dulcolax for sale online – ditropan online order liv52 pills
Lkhddi
eukroma for sale online – purchase dydrogesterone generic buy duphaston generic
Qxrfrl
bactrim 960mg price – buy keppra medication tobramycin 5mg sale
Ypfqlq
griseofulvin 250 mg for sale – order gemfibrozil 300 mg without prescription cheap lopid
Exbqdw
order vasotec 10mg pills – order doxazosin 1mg online cheap oral latanoprost
Uaazgu
buy etodolac 600mg online cheap – etodolac 600mg canada buy pletal pills
Bsrxys
feldene 20mg cost – order rivastigmine 6mg generic buy exelon 6mg for sale
Ibslqv
nootropil ca – secnidazole 20mg tablet buy sinemet generic
AlbertVof
pin-up kazino https://azerbaijancuisine.com/# pin-up online casino
pin-up cazino
Larrynub
pin up casino az: pin up azerbaycan – pin up azerbaycan
RichardJeave
п»їbest mexican online pharmacies purple pharmacy mexico price list mexico pharmacies prescription drugs
Jeffreymycle
http://northern-doctors.org/# reputable mexican pharmacies online
Williamadvam
buying from online mexican pharmacy: mexico drug stores pharmacies – mexico pharmacies prescription drugs
Williamadvam
purple pharmacy mexico price list: northern doctors pharmacy – reputable mexican pharmacies online
Jeffreymycle
https://northern-doctors.org/# mexican mail order pharmacies
Williamadvam
purple pharmacy mexico price list: northern doctors pharmacy – medication from mexico pharmacy
RichardJeave
medicine in mexico pharmacies northern doctors pharmacy mexican border pharmacies shipping to usa
Williamadvam
buying from online mexican pharmacy: pharmacies in mexico that ship to usa – buying from online mexican pharmacy
Jeffreymycle
http://northern-doctors.org/# mexican pharmacy
Williamadvam
mexico drug stores pharmacies: mexican pharmacy northern doctors – mexican border pharmacies shipping to usa
Jeffreymycle
https://northern-doctors.org/# pharmacies in mexico that ship to usa
Williamadvam
pharmacies in mexico that ship to usa: mexican pharmacy online – mexican rx online
RichardJeave
mexico drug stores pharmacies п»їbest mexican online pharmacies mexican drugstore online
Jeffreymycle
http://northern-doctors.org/# medication from mexico pharmacy
Williamadvam
mexico pharmacy: mexican pharmacy northern doctors – medication from mexico pharmacy
Williamadvam
buying prescription drugs in mexico online: Mexico pharmacy that ship to usa – medication from mexico pharmacy
Oihwkf
hydrea for sale online – buy antabuse 250mg for sale purchase robaxin pills
Jeffreymycle
http://northern-doctors.org/# mexican mail order pharmacies
Williamadvam
mexican border pharmacies shipping to usa: mexican northern doctors – mexican border pharmacies shipping to usa
RichardJeave
pharmacies in mexico that ship to usa pharmacies in mexico that ship to usa medication from mexico pharmacy
Williamadvam
mexico drug stores pharmacies: Mexico pharmacy that ship to usa – medication from mexico pharmacy
Williamadvam
mexico pharmacy: northern doctors – mexican drugstore online
Jeffreymycle
http://northern-doctors.org/# mexico drug stores pharmacies
RichardJeave
best online pharmacies in mexico mexican online pharmacies prescription drugs mexican border pharmacies shipping to usa
Williamadvam
buying prescription drugs in mexico: mexico drug stores pharmacies – mexican mail order pharmacies
Jeffreymycle
https://northern-doctors.org/# mexican mail order pharmacies
Williamadvam
pharmacies in mexico that ship to usa: mexican pharmacy – mexican pharmaceuticals online
Williamadvam
mexican pharmaceuticals online: mexican pharmacy – mexico drug stores pharmacies
Jeffreymycle
http://northern-doctors.org/# medicine in mexico pharmacies
Williamadvam
mexican pharmaceuticals online: mexican pharmacy online – mexican pharmaceuticals online
Jeffreymycle
https://northern-doctors.org/# best online pharmacies in mexico
Williamadvam
medication from mexico pharmacy: northern doctors pharmacy – mexico drug stores pharmacies
RichardJeave
mexican pharmaceuticals online northern doctors reputable mexican pharmacies online
Jeffreymycle
https://northern-doctors.org/# mexican pharmacy
Williamadvam
mexican pharmaceuticals online: Mexico pharmacy that ship to usa – mexico drug stores pharmacies
Williamadvam
mexican mail order pharmacies: northern doctors pharmacy – mexican mail order pharmacies
Jeffreymycle
https://northern-doctors.org/# mexican mail order pharmacies
Williamadvam
buying from online mexican pharmacy: mexican pharmacy northern doctors – mexico drug stores pharmacies
Williamadvam
reputable mexican pharmacies online: mexican northern doctors – pharmacies in mexico that ship to usa
Jeffreymycle
https://northern-doctors.org/# buying from online mexican pharmacy
RichardJeave
buying prescription drugs in mexico online northern doctors pharmacy mexico drug stores pharmacies
Jeffreymycle
http://northern-doctors.org/# mexican pharmacy
Williamadvam
medication from mexico pharmacy: northern doctors – mexican pharmaceuticals online
Williamadvam
best online pharmacies in mexico: mexican pharmacy online – mexican mail order pharmacies
Jeffreymycle
http://northern-doctors.org/# mexican pharmacy
RichardJeave
purple pharmacy mexico price list northern doctors reputable mexican pharmacies online
Williamadvam
buying from online mexican pharmacy: Mexico pharmacy that ship to usa – reputable mexican pharmacies online
Etswqz
cost divalproex – buy amiodarone 200mg order topiramate for sale
Jeffreymycle
https://northern-doctors.org/# mexico pharmacies prescription drugs
Williamadvam
medicine in mexico pharmacies: mexican northern doctors – medicine in mexico pharmacies
Williamadvam
reputable mexican pharmacies online: mexican pharmacy – mexican online pharmacies prescription drugs
Jeffreymycle
https://northern-doctors.org/# mexico pharmacies prescription drugs
Williamadvam
mexican rx online: Mexico pharmacy that ship to usa – reputable mexican pharmacies online
Ronniesig
purple pharmacy mexico price list п»їbest mexican online pharmacies mexico pharmacy
Ronniesig
medicine in mexico pharmacies online mexican pharmacy mexican border pharmacies shipping to usa
Ronniesig
buying prescription drugs in mexico online mexican pharmacy mexico drug stores pharmacies
Ronniesig
purple pharmacy mexico price list online mexican pharmacy pharmacies in mexico that ship to usa
Donaldfrono
buying prescription drugs in mexico
http://cmqpharma.com/# mexican mail order pharmacies
pharmacies in mexico that ship to usa
Ronniesig
mexico drug stores pharmacies mexican online pharmacy mexican border pharmacies shipping to usa
Ronniesig
mexican online pharmacies prescription drugs reputable mexican pharmacies online mexican drugstore online
Ronniesig
mexican border pharmacies shipping to usa online mexican pharmacy п»їbest mexican online pharmacies
Ronniesig
mexico pharmacies prescription drugs cmq pharma mexican pharmacy buying prescription drugs in mexico
Nswwuv
buy disopyramide phosphate generic – disopyramide phosphate without prescription order thorazine generic
Hvtjrp
order spironolactone 100mg online – aldactone 25mg ca buy revia 50mg
Ronniesig
mexico drug stores pharmacies cmqpharma.com purple pharmacy mexico price list
Jeffreyrig
https://cmqpharma.com/# п»їbest mexican online pharmacies
purple pharmacy mexico price list
Dafccl
cytoxan over the counter – strattera 25mg generic purchase vastarel pill
Ppaaqe
flexeril for sale online – buy donepezil pill buy vasotec online cheap
Crmuhd
where to buy zofran without a prescription – buy kemadrin without prescription buy generic ropinirole
Hgufsa
buy ascorbic acid 500mg generic – ferrous 100mg tablet prochlorperazine online
Rqckiu
purchase durex gel online cheap – order durex gel for sale buy zovirax online cheap
Ekndqa
buy rogaine sale – proscar 5mg canada proscar 1mg generic
Hxktfu
leflunomide 20mg pills – where to buy risedronate without a prescription buy generic cartidin over the counter
Ixzggf
verapamil 120mg over the counter – diltiazem pills order tenoretic without prescription
Perfhr
cheap atenolol 100mg – order betapace generic coreg 6.25mg drug
Ylwhwb
buy cheap generic atorlip – zestril order bystolic usa
Pztotq
buy gasex tablets – diabecon order where to buy diabecon without a prescription
Davidoceat
canadian pharmacy com: legal to buy prescription drugs from canada – vipps canadian pharmacy
Davidoceat
online pharmacy india: indian pharmacy – india pharmacy
Edwardmop
http://foruspharma.com/# best online pharmacies in mexico
Edwardmop
https://canadapharmast.com/# reddit canadian pharmacy
Charleskep
indianpharmacy com reputable indian pharmacies indian pharmacies safe
Davidoceat
canadian discount pharmacy: online canadian pharmacy – canadian pharmacy online store
Davidoceat
mexican rx online: mexico drug stores pharmacies – mexican pharmaceuticals online
Michaelhig
india pharmacy mail order: india pharmacy – Online medicine home delivery
Davidoceat
canadian pharmacy oxycodone: canadian pharmacy no scripts – canada drugs
Davidoceat
medicine in mexico pharmacies: buying from online mexican pharmacy – mexican pharmacy
Charleskep
pharmacies in mexico that ship to usa mexico drug stores pharmacies buying from online mexican pharmacy
Michaelhig
canadian world pharmacy: canada pharmacy world – my canadian pharmacy review
Edwardmop
https://foruspharma.com/# mexican pharmaceuticals online
Edwardmop
https://foruspharma.com/# п»їbest mexican online pharmacies
Michaelhig
cheap canadian pharmacy online: canadian pharmacy 1 internet online drugstore – reliable canadian pharmacy
Davidoceat
canada pharmacy reviews: reddit canadian pharmacy – trusted canadian pharmacy
Davidoceat
ed drugs online from canada: best canadian pharmacy online – reliable canadian online pharmacy
Michaelhig
mexico drug stores pharmacies: buying prescription drugs in mexico online – п»їbest mexican online pharmacies
Charleskep
pharmacies in mexico that ship to usa mexico pharmacy medication from mexico pharmacy
Edwardmop
http://indiapharmast.com/# top online pharmacy india
Edwardmop
https://canadapharmast.com/# canadian pharmacy
Charleskep
buy prescription drugs from india online shopping pharmacy india top online pharmacy india
Davidoceat
best canadian online pharmacy: recommended canadian pharmacies – canadian pharmacy oxycodone
Davidoceat
mexican border pharmacies shipping to usa: purple pharmacy mexico price list – mexican mail order pharmacies
Michaelhig
buying from online mexican pharmacy: reputable mexican pharmacies online – mexican pharmacy
Charleskep
reputable canadian online pharmacy best online canadian pharmacy cheap canadian pharmacy online
Davidoceat
mexican drugstore online: best online pharmacies in mexico – mexican online pharmacies prescription drugs
Davidoceat
top 10 pharmacies in india: indian pharmacy online – reputable indian pharmacies
Nczxxh
lasuna order – order lasuna pills himcolin without prescription
Davidoceat
top 10 online pharmacy in india: cheapest online pharmacy india – india online pharmacy
Davidoceat
canadian pharmacy antibiotics: online canadian pharmacy review – best online canadian pharmacy
ThomasErert
http://paxloviddelivery.pro/# Paxlovid buy online
ThomasErert
https://doxycyclinedelivery.pro/# can you buy doxycycline over the counter australia
Jameslab
buy doxycycline 100mg online uk: doxycycline hyclate 100 mg – doxycycline 100mg capsule sale
Jameslab
ciprofloxacin order online: buy cipro cheap – buy cipro
ThomasErert
http://ciprodelivery.pro/# purchase cipro
ThomasErert
https://clomiddelivery.pro/# where to buy generic clomid without a prescription
Jameslab
doxycycline 150 mg tablets: doxycycline brand name canada – 20 doxycycline
ThomasErert
https://paxloviddelivery.pro/# Paxlovid buy online
ThomasErert
http://ciprodelivery.pro/# ciprofloxacin over the counter
ThomasErert
https://clomiddelivery.pro/# how to buy cheap clomid no prescription
ThomasErert
http://amoxildelivery.pro/# amoxicillin no prescription
Jameslab
paxlovid buy: paxlovid generic – buy paxlovid online
Jameslab
875 mg amoxicillin cost: amoxicillin without a doctors prescription – cost of amoxicillin 875 mg
ThomasErert
http://ciprodelivery.pro/# buy cipro online canada
ThomasErert
http://paxloviddelivery.pro/# paxlovid price
Cbpnzl
where to buy norfloxacin without a prescription – cheap generic confido confido tablets
Jameslab
cipro for sale: where to buy cipro online – ciprofloxacin 500 mg tablet price
Jameslab
can i purchase generic clomid prices: buying generic clomid without insurance – order cheap clomid without prescription
ThomasErert
http://clomiddelivery.pro/# order generic clomid without rx
ThomasErert
http://paxloviddelivery.pro/# paxlovid pill
ThomasErert
https://clomiddelivery.pro/# cost clomid without insurance
ThomasErert
http://amoxildelivery.pro/# where can i get amoxicillin 500 mg
Jameslab
paxlovid buy: paxlovid for sale – paxlovid generic
Jameslab
doxycycline price mexico: doxycycline 40 mg generic coupon – doxycycline 40 mg generic coupon
ThomasErert
https://clomiddelivery.pro/# can you get clomid without insurance
ThomasErert
http://paxloviddelivery.pro/# Paxlovid over the counter
ThomasErert
https://paxloviddelivery.pro/# paxlovid generic
ThomasErert
http://amoxildelivery.pro/# medicine amoxicillin 500
Jameslab
where to buy cipro online: cipro pharmacy – cipro for sale
Jameslab
buy cipro without rx: ciprofloxacin over the counter – cipro ciprofloxacin
Jameslab
generic clomid tablets: generic clomid – how can i get cheap clomid without insurance
Jameslab
paxlovid buy: paxlovid pill – paxlovid buy
Jameslab
buy cipro without rx: cipro 500mg best prices – buy cipro without rx
RobertRer
cipro for sale: buy cipro online – cipro 500mg best prices
Zvffyg
order finax without prescription – generic finax uroxatral 10mg ca
Yicean
where to buy speman without a prescription – cheap himplasia pills finasteride tablets
RichardLop
https://mexicandeliverypharma.com/# buying prescription drugs in mexico
WaynemoRry
mexico pharmacies prescription drugs: mexico pharmacies prescription drugs – mexico pharmacies prescription drugs
Dominicnaw
buying prescription drugs in mexico: mexican drugstore online – buying prescription drugs in mexico
WaynemoRry
mexico pharmacies prescription drugs: buying from online mexican pharmacy – mexican border pharmacies shipping to usa
Arnoldgeony
mexican pharmacy buying prescription drugs in mexico online buying prescription drugs in mexico online
Arnoldgeony
purple pharmacy mexico price list medicine in mexico pharmacies buying prescription drugs in mexico online
Dominicnaw
medication from mexico pharmacy: mexican mail order pharmacies – mexican drugstore online
WaynemoRry
medication from mexico pharmacy: mexican border pharmacies shipping to usa – mexican rx online
RichardLop
https://mexicandeliverypharma.online/# mexican pharmaceuticals online
RichardLop
https://mexicandeliverypharma.online/# mexico pharmacies prescription drugs
Arnoldgeony
medicine in mexico pharmacies mexican drugstore online buying from online mexican pharmacy
Dominicnaw
medicine in mexico pharmacies: best online pharmacies in mexico – medicine in mexico pharmacies
WaynemoRry
п»їbest mexican online pharmacies: mexican mail order pharmacies – purple pharmacy mexico price list
RichardLop
http://mexicandeliverypharma.com/# mexico pharmacies prescription drugs
RichardLop
http://mexicandeliverypharma.com/# mexican mail order pharmacies
NelsonBew
mexican rx online: mexican border pharmacies shipping to usa – mexico drug stores pharmacies
NelsonBew
mexican online pharmacies prescription drugs: mexican border pharmacies shipping to usa – mexico pharmacies prescription drugs
Dominicnaw
mexico pharmacies prescription drugs: mexico pharmacies prescription drugs – medication from mexico pharmacy
WaynemoRry
medicine in mexico pharmacies: buying prescription drugs in mexico – mexico drug stores pharmacies
Dominicnaw
pharmacies in mexico that ship to usa: medication from mexico pharmacy – medicine in mexico pharmacies
WaynemoRry
medication from mexico pharmacy: buying from online mexican pharmacy – mexican border pharmacies shipping to usa
RichardLop
https://mexicandeliverypharma.com/# reputable mexican pharmacies online
RichardLop
http://mexicandeliverypharma.com/# medicine in mexico pharmacies
WaynemoRry
medication from mexico pharmacy: medication from mexico pharmacy – medicine in mexico pharmacies
Arnoldgeony
purple pharmacy mexico price list mexican mail order pharmacies mexico pharmacies prescription drugs
NelsonBew
п»їbest mexican online pharmacies: medication from mexico pharmacy – purple pharmacy mexico price list
Dominicnaw
buying prescription drugs in mexico: best online pharmacies in mexico – reputable mexican pharmacies online
WaynemoRry
buying prescription drugs in mexico online: mexico drug stores pharmacies – pharmacies in mexico that ship to usa
Dominicnaw
mexico drug stores pharmacies: п»їbest mexican online pharmacies – mexico drug stores pharmacies
WaynemoRry
buying from online mexican pharmacy: reputable mexican pharmacies online – п»їbest mexican online pharmacies
Arnoldgeony
mexican pharmaceuticals online п»їbest mexican online pharmacies purple pharmacy mexico price list
Arnoldgeony
reputable mexican pharmacies online mexican online pharmacies prescription drugs mexico drug stores pharmacies
NelsonBew
medicine in mexico pharmacies: mexico drug stores pharmacies – purple pharmacy mexico price list
NelsonBew
mexican drugstore online: mexico drug stores pharmacies – medication from mexico pharmacy
Dominicnaw
buying prescription drugs in mexico online: medicine in mexico pharmacies – mexico drug stores pharmacies
Dominicnaw
mexican online pharmacies prescription drugs: mexican rx online – medicine in mexico pharmacies
WaynemoRry
pharmacies in mexico that ship to usa: п»їbest mexican online pharmacies – reputable mexican pharmacies online
Arnoldgeony
mexican online pharmacies prescription drugs mexico drug stores pharmacies mexican pharmaceuticals online
Arnoldgeony
mexican pharmacy mexico pharmacy medicine in mexico pharmacies
NelsonBew
medication from mexico pharmacy: п»їbest mexican online pharmacies – mexican rx online
Dominicnaw
buying prescription drugs in mexico online: best online pharmacies in mexico – mexican drugstore online
WaynemoRry
reputable mexican pharmacies online: medication from mexico pharmacy – buying prescription drugs in mexico
Dominicnaw
buying prescription drugs in mexico: mexican online pharmacies prescription drugs – mexican border pharmacies shipping to usa
NelsonBew
mexican mail order pharmacies: reputable mexican pharmacies online – mexican rx online
NelsonBew
buying prescription drugs in mexico online: purple pharmacy mexico price list – reputable mexican pharmacies online
Dominicnaw
mexican drugstore online: mexico pharmacies prescription drugs – buying from online mexican pharmacy
Dominicnaw
mexico pharmacies prescription drugs: mexico drug stores pharmacies – mexican drugstore online
Arnoldgeony
mexico pharmacy mexican pharmacy mexican rx online
NelsonBew
mexican online pharmacies prescription drugs: mexico drug stores pharmacies – mexican online pharmacies prescription drugs
NelsonBew
mexican online pharmacies prescription drugs: pharmacies in mexico that ship to usa – buying prescription drugs in mexico
Oqotsz
hytrin 5mg usa – priligy 90mg price buy dapoxetine medication
Dominicnaw
mexican rx online: buying prescription drugs in mexico online – medication from mexico pharmacy
WaynemoRry
mexican border pharmacies shipping to usa: mexico drug stores pharmacies – pharmacies in mexico that ship to usa
Arnoldgeony
mexico pharmacies prescription drugs mexican border pharmacies shipping to usa mexican mail order pharmacies
NelsonBew
buying prescription drugs in mexico: purple pharmacy mexico price list – mexican online pharmacies prescription drugs
NelsonBew
mexican online pharmacies prescription drugs: purple pharmacy mexico price list – buying prescription drugs in mexico
Dominicnaw
mexican rx online: purple pharmacy mexico price list – buying prescription drugs in mexico online
Dominicnaw
medicine in mexico pharmacies: purple pharmacy mexico price list – mexican border pharmacies shipping to usa
WaynemoRry
mexican mail order pharmacies: mexico pharmacies prescription drugs – pharmacies in mexico that ship to usa
Arnoldgeony
reputable mexican pharmacies online mexican pharmaceuticals online mexico pharmacy
NelsonBew
purple pharmacy mexico price list: pharmacies in mexico that ship to usa – mexican online pharmacies prescription drugs
NelsonBew
п»їbest mexican online pharmacies: mexican pharmaceuticals online – purple pharmacy mexico price list
Dominicnaw
pharmacies in mexico that ship to usa: reputable mexican pharmacies online – mexican border pharmacies shipping to usa
Dominicnaw
mexico pharmacies prescription drugs: п»їbest mexican online pharmacies – buying prescription drugs in mexico
WaynemoRry
buying from online mexican pharmacy: mexico drug stores pharmacies – purple pharmacy mexico price list
WaynemoRry
mexican online pharmacies prescription drugs: mexican drugstore online – buying prescription drugs in mexico
Arnoldgeony
mexican mail order pharmacies pharmacies in mexico that ship to usa mexico pharmacies prescription drugs
NelsonBew
mexican pharmaceuticals online: mexican online pharmacies prescription drugs – mexican pharmaceuticals online
Dominicnaw
mexican pharmaceuticals online: mexican drugstore online – mexico pharmacies prescription drugs
Dominicnaw
mexican pharmaceuticals online: mexico drug stores pharmacies – buying prescription drugs in mexico online
WaynemoRry
mexican pharmaceuticals online: mexican drugstore online – buying prescription drugs in mexico online
Arnoldgeony
п»їbest mexican online pharmacies mexican rx online buying prescription drugs in mexico online
tlover tonet
I’m very happy to read this. This is the kind of manual that needs to be given and not the random misinformation that is at the other blogs. Appreciate your sharing this best doc.
Dominicnaw
mexico drug stores pharmacies: best online pharmacies in mexico – medication from mexico pharmacy
WaynemoRry
purple pharmacy mexico price list: mexican online pharmacies prescription drugs – medication from mexico pharmacy
Arnoldgeony
buying prescription drugs in mexico buying prescription drugs in mexico online mexican pharmaceuticals online
NelsonBew
mexico drug stores pharmacies: п»їbest mexican online pharmacies – buying prescription drugs in mexico online
NelsonBew
best online pharmacies in mexico: medication from mexico pharmacy – buying prescription drugs in mexico
Dominicnaw
buying prescription drugs in mexico online: mexican online pharmacies prescription drugs – mexico pharmacies prescription drugs
Dominicnaw
mexican online pharmacies prescription drugs: pharmacies in mexico that ship to usa – п»їbest mexican online pharmacies
WaynemoRry
buying from online mexican pharmacy: buying prescription drugs in mexico – mexican drugstore online
WaynemoRry
mexican rx online: mexican mail order pharmacies – pharmacies in mexico that ship to usa
Arnoldgeony
mexican pharmaceuticals online mexico drug stores pharmacies mexican pharmaceuticals online
Arnoldgeony
mexican rx online pharmacies in mexico that ship to usa п»їbest mexican online pharmacies
Dominicnaw
mexican mail order pharmacies: mexican border pharmacies shipping to usa – mexico pharmacies prescription drugs
WaynemoRry
mexican pharmaceuticals online: mexico drug stores pharmacies – mexican pharmaceuticals online
WaynemoRry
mexican online pharmacies prescription drugs: mexican mail order pharmacies – mexican drugstore online
Arnoldgeony
reputable mexican pharmacies online reputable mexican pharmacies online п»їbest mexican online pharmacies
Dominicnaw
purple pharmacy mexico price list: mexican drugstore online – mexican online pharmacies prescription drugs
NelsonBew
buying prescription drugs in mexico online: pharmacies in mexico that ship to usa – mexican mail order pharmacies
NelsonBew
mexican pharmaceuticals online: mexican online pharmacies prescription drugs – mexican rx online
WaynemoRry
purple pharmacy mexico price list: buying prescription drugs in mexico online – mexican pharmaceuticals online
Arnoldgeony
pharmacies in mexico that ship to usa mexican drugstore online purple pharmacy mexico price list
Arnoldgeony
medication from mexico pharmacy mexican pharmaceuticals online mexican online pharmacies prescription drugs
WaynemoRry
п»їbest mexican online pharmacies: buying from online mexican pharmacy – purple pharmacy mexico price list
Arnoldgeony
mexico drug stores pharmacies buying prescription drugs in mexico mexico pharmacy
Dominicnaw
medication from mexico pharmacy: reputable mexican pharmacies online – buying prescription drugs in mexico online
Dominicnaw
mexican border pharmacies shipping to usa: п»їbest mexican online pharmacies – medication from mexico pharmacy
RobertSmeli
cytotec pills buy online cytotec online buy cytotec online
MatthewHealk
buy generic propecia: cost generic propecia without insurance – cost cheap propecia prices
MatthewHealk
buy azithromycin zithromax: zithromax 500mg over the counter – zithromax 600 mg tablets
Lewisgom
https://cytotecbestprice.pro/# buy cytotec in usa
Patricktef
https://zithromaxbestprice.pro/# generic zithromax azithromycin
Lewisgom
http://cytotecbestprice.pro/# cytotec online
RobertSmeli
order cytotec online Cytotec 200mcg price cytotec abortion pill
RobertSmeli
prednisone cost in india prednisone 60 mg daily prednisone 100 mg
Patricktef
https://zithromaxbestprice.pro/# can you buy zithromax online
Lewisgom
http://nolvadexbestprice.pro/# tamoxifen breast cancer
RobertSmeli
home buying propecia tablets buy propecia without prescription
MatthewHealk
tamoxifen for breast cancer prevention: aromatase inhibitors tamoxifen – femara vs tamoxifen
Patricktef
https://nolvadexbestprice.pro/# nolvadex steroids
Lewisgom
https://zithromaxbestprice.pro/# where can i purchase zithromax online
Lewisgom
https://cytotecbestprice.pro/# cytotec online
RobertSmeli
buy cytotec pills buy cytotec in usa buy cytotec
MatthewHealk
liquid tamoxifen: tamoxifen cyp2d6 – effexor and tamoxifen
MatthewHealk
lexapro and tamoxifen: tamoxifen alternatives premenopausal – tamoxifen hot flashes
Dxyyqf
order trileptal online cheap – trileptal 600mg usa cheap levoxyl tablets
MatthewHealk
order propecia without a prescription: get generic propecia without insurance – buy propecia without prescription
MatthewHealk
cost propecia without dr prescription: propecia generic – get cheap propecia tablets
Kevinadoth
prednisone generic brand name: cheap prednisone 20 mg – prednisone 40 mg price
Lewisgom
https://propeciabestprice.pro/# rx propecia
Lewisgom
http://cytotecbestprice.pro/# п»їcytotec pills online
MatthewHealk
zithromax 250mg: where to get zithromax – zithromax online australia
MatthewHealk
how to get prednisone tablets: 10 mg prednisone – prednisone 20 mg tablets
Lewisgom
https://cytotecbestprice.pro/# buy cytotec pills online cheap
Lewisgom
http://nolvadexbestprice.pro/# nolvadex gynecomastia
MatthewHealk
nolvadex pills: tamoxifen hormone therapy – tamoxifen breast cancer prevention
MatthewHealk
nolvadex estrogen blocker: tamoxifen and uterine thickening – lexapro and tamoxifen
MatthewHealk
prednisone buy: where can i buy prednisone without prescription – prednisone over the counter australia
Lewisgom
https://nolvadexbestprice.pro/# pct nolvadex
MatthewHealk
buy misoprostol over the counter: purchase cytotec – п»їcytotec pills online
MatthewHealk
propecia generic: propecia without insurance – cost of propecia without dr prescription
Lewisgom
http://zithromaxbestprice.pro/# how to get zithromax
RandyGop
п»їFarmacia online migliore: Farmacie on line spedizione gratuita – farmacie online autorizzate elenco
JasonHox
viagra generico prezzo piГ№ basso: viagra online – viagra 50 mg prezzo in farmacia https://cialisgenerico.life/# farmacia online farmacie online autorizzate elenco Cialis generico 20 mg 8 compresse prezzo comprare farmaci online con ricetta
TomasSit
Farmacie online sicure: Avanafil prezzo – acquisto farmaci con ricetta
RandyGop
esiste il viagra generico in farmacia: viagra senza prescrizione – viagra ordine telefonico
RandyGop
migliori farmacie online 2024: Avanafil compresse – farmacie online sicure
Timothyimish
http://cialisgenerico.life/# farmacie online affidabili
Timothyimish
http://kamagrait.pro/# Farmacia online miglior prezzo
RandyGop
acquisto farmaci con ricetta: kamagra gel prezzo – farmacia online piГ№ conveniente
TomasSit
Farmacie on line spedizione gratuita: farmacia online migliore – farmacie online affidabili
Timothyimish
https://cialisgenerico.life/# Farmacie on line spedizione gratuita
Timothyimish
http://avanafil.pro/# п»їFarmacia online migliore
CharlesGrity
farmacia online top farmacia online or Farmacie on line spedizione gratuita https://www.google.mn/url?sa=t&url=https://farmait.store comprare farmaci online con ricetta Farmacia online miglior prezzo farmacia online senza ricetta and Farmacie on line spedizione gratuita farmacie online sicure
ElliottJog
viagra 100 mg prezzo in farmacia viagra generico sandoz or miglior sito dove acquistare viagra http://hamas.opoint.com/?url=http://viagragenerico.site cialis farmacia senza ricetta esiste il viagra generico in farmacia viagra originale in 24 ore contrassegno and esiste il viagra generico in farmacia miglior sito per comprare viagra online
TomasSit
farmacie online sicure: Cialis generico farmacia – farmacie online autorizzate elenco
Timothyimish
http://farmait.store/# acquistare farmaci senza ricetta
Timothyimish
http://avanafil.pro/# farmacia online senza ricetta
CharlesGrity
farmacia online senza ricetta comprare farmaci online allestero or farmacia online http://www.google.fm/url?q=https://farmait.store comprare farmaci online con ricetta comprare farmaci online con ricetta migliori farmacie online 2024 and farmacia online acquisto farmaci con ricetta
CharlesGrity
farmacia online piГ№ conveniente migliori farmacie online 2024 or farmacia online piГ№ conveniente https://cse.google.co.zw/url?sa=t&url=https://farmait.store farmaci senza ricetta elenco acquisto farmaci con ricetta farmacie online sicure and comprare farmaci online con ricetta п»їFarmacia online migliore
Georgepal
buy generic viagra online: Cheap generic Viagra – buy viagra online
Samuelzet
http://tadalafil.auction/# how does cialis work in the body
Samuelzet
http://sildenafil.llc/# generic viagra
Georgepal
cialis soft tabs canadian pharmacy: Buy Cialis online – can i buy cialis without prescription pay pal
ClaytonFrets
cheapest generic cialis online: Generic Tadalafil 20mg price – cialis black review http://tadalafil.auction/# cialis us pharmacy order cialis no prescription cheapest tadalafil cialis payment paypal
WalkerBit
viagra viagra canada or ed pills that work better than viagra https://www.google.bs/url?sa=t&url=https://sildenafil.llc buy viagra order viagra order viagra online and viagra samples buy viagra professional
Victordub
viagra for women viagra without a doctor prescription usa or viagra https://www.google.mv/url?sa=t&url=https://sildenafil.llc viagra for sale viagra vs cialis ed pills that work better than viagra and buy viagra generic buy viagra online
Stephenkadly
https://sildenafil.llc/# cialis vs viagra buy viagra cialis mix online Buy Cialis online top web source for cialis
Stephenkadly
https://sildenafil.llc/# viagra prices 100 mg viagra lowest price Buy Viagra online cheap order viagra online
Georgepal
free viagra: Viagra without a doctor prescription – cost of viagra
Samuelzet
http://sildenafil.llc/# blue pill viagra
Georgepal
viagra pills: buy sildenafil online usa – real viagra without a doctor prescription
Samuelzet
http://tadalafil.auction/# buying cialis online canadian order
ClaytonFrets
generic viagra: Cheap Viagra online – viagra pills https://sildenafil.llc/# over the counter alternative to viagra buy viagra Cheap generic Viagra how long does viagra last
Georgepal
buy viagra professional: Buy Viagra online cheap – buy viagra generic
JulioBum
buy generic cialis online overnight cialis online from canada or cheap cialis online overnight shipping https://cse.google.com.sl/url?q=https://tadalafil.auction cialis online nz does the va approve cialis for patients does the va approve cialis for patients and where can i buy cialis in canada cialis sale online
Samuelzet
https://sildenafil.llc/# generic viagra 100mg
Samuelzet
https://tadalafil.auction/# cialis canada pharmacy no prescription required
WalkerBit
buy viagra order generic viagra without a doctor prescription or viagra samples https://www.google.mn/url?q=https://sildenafil.llc generic viagra buy viagra buy viagra professional and cheap viagra cheap viagra
Stephenkadly
http://sildenafil.llc/# viagra cialis in melbourne find cheapest cialis pills cialis legal purchase
Douglasjeows
buying erectile dysfunction pills online: Cheapest online ED treatment – cheap erectile dysfunction pills
Rubvgq
how to buy cyclosporine – how to get imusporin without a prescription colchicine buy online
Leonardirowl
https://mexicopharmacy.win/# pharmacies in mexico that ship to usa
Leonardirowl
https://indiapharmacy.shop/# online shopping pharmacy india
Douglasjeows
best online pharmacies in mexico: Purple pharmacy online ordering – mexican border pharmacies shipping to usa
RobertCal
buying prescription drugs in mexico: mexican pharmacy – mexican pharmacy https://indiapharmacy.shop/# п»їlegitimate online pharmacies india Online medicine order Best Indian pharmacy п»їlegitimate online pharmacies india
RobertCal
pharmacies in mexico that ship to usa: Certified Mexican pharmacy – mexican drugstore online http://indiapharmacy.shop/# reputable indian pharmacies reputable indian online pharmacy Indian pharmacy international shipping indianpharmacy com
Douglasjeows
how to get ed meds online: ED meds online with insurance – ed meds cheap
Leonardirowl
https://edpillpharmacy.store/# cheap ed medication
Leonardirowl
http://indiapharmacy.shop/# top 10 pharmacies in india
Douglasjeows
pills for ed online: Best ED meds online – cheap ed medicine
Geraldgew
buy ed medication buy erectile dysfunction pills online or buy erectile dysfunction pills online https://clients1.google.com.om/url?q=https://edpillpharmacy.store best online ed treatment erectile dysfunction pills for sale where can i buy erectile dysfunction pills and ed meds online ed treatment online
RichardCohot
order ed meds online best online ed medication or low cost ed meds online https://cse.google.com.nf/url?q=https://edpillpharmacy.store generic ed meds online best ed meds online cheapest ed online and ed drugs online order ed pills
Douglasjeows
п»їed pills online: ED meds online with insurance – get ed meds online
Leonardirowl
http://mexicopharmacy.win/# reputable mexican pharmacies online
Leonardirowl
http://indiapharmacy.shop/# Online medicine order
RobertCal
mexican pharmacy: п»їbest mexican online pharmacies – best online pharmacies in mexico http://indiapharmacy.shop/# buy prescription drugs from india reputable indian pharmacies Top mail order pharmacies Online medicine order
RobertCal
pharmacies in mexico that ship to usa: mexican pharmacy – п»їbest mexican online pharmacies http://indiapharmacy.shop/# mail order pharmacy india mexican drugstore online Certified Mexican pharmacy mexican border pharmacies shipping to usa
GeorgeBen
indian pharmacy best india pharmacy or Online medicine order https://maps.google.fm/url?q=https://indiapharmacy.shop reputable indian pharmacies indian pharmacy paypal top 10 online pharmacy in india and india pharmacy cheapest online pharmacy india
GeorgeBen
cheapest online pharmacy india top online pharmacy india or reputable indian pharmacies https://images.google.com.nf/url?q=https://indiapharmacy.shop buy medicines online in india buy prescription drugs from india cheapest online pharmacy india and online shopping pharmacy india buy medicines online in india
Douglasjeows
mail order pharmacy india: Online India pharmacy – pharmacy website india
Leonardirowl
https://edpillpharmacy.store/# online ed meds
RichardCohot
best ed pills online buy ed meds online or п»їed pills online https://images.google.cat/url?q=http://edpillpharmacy.store buy ed meds п»їed pills online affordable ed medication and online ed medication ed prescription online
RobertCal
mail order pharmacy india: Cheapest online pharmacy – cheapest online pharmacy india http://edpillpharmacy.store/# ed medicine online indian pharmacies safe Top mail order pharmacies best online pharmacy india
RobertCal
buying prescription drugs in mexico: reputable mexican pharmacies online – mexican mail order pharmacies http://indiapharmacy.shop/# top online pharmacy india indian pharmacies safe Indian pharmacy international shipping online shopping pharmacy india
Douglasjeows
indian pharmacies safe: Top online pharmacy in India – indian pharmacy paypal
Leonardirowl
https://mexicopharmacy.win/# purple pharmacy mexico price list
RichardCohot
ed pills for sale online ed medicine or cheapest online ed meds https://cse.google.mu/url?sa=t&url=https://edpillpharmacy.store online ed medications cheapest ed online where can i buy erectile dysfunction pills and ed treatments online cheap ed drugs
GeorgeBen
п»їlegitimate online pharmacies india top online pharmacy india or pharmacy website india https://www.musashikoyama-palm.com/modules/information6/wp-ktai.php?view=redir&url=http://indiapharmacy.shop Online medicine order indian pharmacy reputable indian pharmacies and Online medicine order top online pharmacy india
GeorgeBen
top 10 pharmacies in india online pharmacy india or world pharmacy india http://hamas.opoint.com/?url=http://indiapharmacy.shop best india pharmacy mail order pharmacy india india pharmacy mail order and indian pharmacy top 10 online pharmacy in india
Etepbs
lactulose for sale – buy duphalac generic order betahistine 16mg generic
RobertCal
ed medications online: ED meds online with insurance – cost of ed meds https://indiapharmacy.shop/# top 10 online pharmacy in india best india pharmacy Online pharmacy best india pharmacy
RobertCal
pharmacies in mexico that ship to usa: Best pharmacy in Mexico – purple pharmacy mexico price list http://mexicopharmacy.win/# purple pharmacy mexico price list mexico pharmacy Purple pharmacy online ordering mexican online pharmacies prescription drugs
Douglasjeows
where can i buy ed pills: Cheapest online ED treatment – best online ed medication
Leonardirowl
https://edpillpharmacy.store/# buy erectile dysfunction pills
Leonardirowl
http://edpillpharmacy.store/# where can i buy ed pills
Douglasjeows
mexican pharmaceuticals online: Certified Mexican pharmacy – medicine in mexico pharmacies
Douglasjeows
online ed pills: Cheapest online ED treatment – online prescription for ed
Douglasjeows
pharmacies in mexico that ship to usa: Best pharmacy in Mexico – reputable mexican pharmacies online
RichardCohot
top rated ed pills how to get ed meds online or ed medications online https://images.google.com.bz/url?q=http://edpillpharmacy.store buying ed pills online online ed medications buy ed meds and best ed pills online online ed pharmacy
Douglasjeows
india pharmacy mail order: Indian pharmacy international shipping – top online pharmacy india
Leonardirowl
https://indiapharmacy.shop/# best online pharmacy india
RobertCal
mexican border pharmacies shipping to usa: Mexico pharmacy online – mexico pharmacy http://indiapharmacy.shop/# buy prescription drugs from india where can i buy erectile dysfunction pills Cheap ED pills online where can i buy erectile dysfunction pills
RobertCal
pharmacy website india: Best Indian pharmacy – online pharmacy india http://edpillpharmacy.store/# online erectile dysfunction prescription indian pharmacy Online pharmacy USA Online medicine order
Douglasjeows
mexican pharmaceuticals online: Medicines Mexico – mexican border pharmacies shipping to usa
Douglasjeows
erectile dysfunction online: online ed prescription same-day – cheap ed
Leonardirowl
https://mexicopharmacy.win/# buying from online mexican pharmacy
Leonardirowl
https://edpillpharmacy.store/# erection pills online
RichardCohot
what is the cheapest ed medication ed online meds or online prescription for ed http://underground.co.za/redirect/?url=http://edpillpharmacy.store edmeds best ed pills online erectile dysfunction online and ed treatments online ed medicine online
RichardCohot
online ed meds cheap ed or discount ed meds https://www.google.dz/url?q=https://edpillpharmacy.store cheap ed medicine low cost ed pills where can i buy ed pills and erectile dysfunction online low cost ed medication
RobertCal
world pharmacy india: Top online pharmacy in India – top 10 pharmacies in india http://mexicopharmacy.win/# medicine in mexico pharmacies mexico drug stores pharmacies mexican pharmacy pharmacies in mexico that ship to usa
RobertCal
mexican drugstore online: mexico pharmacies prescription drugs – mexico pharmacies prescription drugs http://edpillpharmacy.store/# buy ed pills online buy medicines online in india Top online pharmacy in India buy prescription drugs from india
Wiyqdi
purchase deflazacort pills – deflazacort medication brimonidine sale
Leonardirowl
https://mexicopharmacy.win/# reputable mexican pharmacies online
Leonardirowl
http://edpillpharmacy.store/# ed medicines
Douglasjeows
buying prescription drugs in mexico online: mexico pharmacy win – buying prescription drugs in mexico
RichardCohot
discount ed pills cheapest ed medication or ed pills cheap https://cse.google.pt/url?sa=t&url=https://edpillpharmacy.store erectile dysfunction medications online order ed pills online buy ed medication online and online ed prescription best online ed meds
RobertCal
top 10 pharmacies in india: Top online pharmacy in India – indian pharmacy online http://mexicopharmacy.win/# mexican pharmaceuticals online ed pills for sale ed pills online online ed prescription
RobertCal
buy ed medication online: ed pills online – how to get ed meds online https://indiapharmacy.shop/# indianpharmacy com buy medicines online in india Online India pharmacy indian pharmacy
Douglasjeows
mexican mail order pharmacies: Best online Mexican pharmacy – buying prescription drugs in mexico online
Douglasjeows
pharmacies in mexico that ship to usa: mexican pharmacy – mexican mail order pharmacies
Douglasjeows
best ed medication online: Cheapest online ED treatment – best online ed medication
RichardCohot
erectile dysfunction online where can i get ed pills or cheap ed meds online https://myspace.com/edpillpharmacy.store discount ed meds online ed pharmacy ed treatment online and discount ed meds erectile dysfunction medicine online
Douglasjeows
online erectile dysfunction medication: online ed prescription same-day – what is the cheapest ed medication
RobertCal
cheap ed drugs: Best ED meds online – cheapest ed meds http://indiapharmacy.shop/# Online medicine order erectile dysfunction drugs online online ed prescription same-day affordable ed medication
RobertCal
reputable indian pharmacies: Indian pharmacy international shipping – top online pharmacy india https://edpillpharmacy.store/# online erectile dysfunction prescription erectile dysfunction online prescription ed pills online online erectile dysfunction
Douglasjeows
cheap ed medication: cheap ed pills online – п»їed pills online
Douglasjeows
reputable indian online pharmacy: Online pharmacy USA – indian pharmacy paypal
Douglasjeows
п»їbest mexican online pharmacies: Purple pharmacy online ordering – medicine in mexico pharmacies
RichardCohot
buying erectile dysfunction pills online erectile dysfunction pills online or ed meds online https://cse.google.co.th/url?q=https://edpillpharmacy.store cheap ed cheap boner pills ed meds online and online ed medication ed online pharmacy
RichardCohot
ed medicines online buy erectile dysfunction medication or cheapest ed treatment http://naiyoujc.ff66.net/productshow.asp?id=30&mnid=51913&url=http://edpillpharmacy.store edmeds where can i get ed pills get ed meds online and cheap ed meds online discount ed meds
RobertCal
reputable mexican pharmacies online: mexican rx online – mexico drug stores pharmacies https://mexicopharmacy.win/# mexican drugstore online india pharmacy Online pharmacy india online pharmacy
RobertCal
best online pharmacy india: Online India pharmacy – world pharmacy india http://indiapharmacy.shop/# п»їlegitimate online pharmacies india erectile dysfunction online Cheap ED pills online cheapest ed meds
Dominic Millberg
Unquestionably believe that that you stated. Your favourite reason seemed to be on the net the easiest factor to bear in mind of. I say to you, I definitely get irked while other people consider concerns that they just don’t understand about. You controlled to hit the nail upon the highest as well as outlined out the entire thing without having side effect , people can take a signal. Will likely be again to get more. Thank you
Frxlwj
order generic besifloxacin – purchase besivance for sale order sildamax pills
StanleyHelia
buy cytotec cheapest cytotec buy cytotec online
Stephendup
https://lipitor.guru/# best price lipitor
Stephendup
https://lipitor.guru/# cheap lipitor 20 mg
JamesKnosy
lipitor 80: buy atorvastatin online – lipitor 4
DanielVum
cytotec online https://furosemide.win/# lasix pills
furosemida 40 mg
StanleyHelia
buy tamoxifen Purchase Nolvadex Online tamoxifen bone pain
DanielVum
buy cytotec over the counter http://furosemide.win/# lasix furosemide 40 mg
lasix for sale
MichaelStorm
lasix furosemide: furosemide online – lasix furosemide https://lisinopril.guru/# lisinopril 10 mg best price lisinopril tabs 4mg Lisinopril refill online prinivil 20 mg
MichaelStorm
cytotec online: cytotec best price – buy cytotec online https://lisinopril.guru/# lisinopril 20 mg uk buy cytotec over the counter Abortion pills online buy cytotec pills online cheap
Stephendup
http://tamoxifen.bid/# where can i buy nolvadex
Stephendup
https://tamoxifen.bid/# tamoxifen reviews
DanielVum
cytotec pills buy online https://tamoxifen.bid/# tamoxifen hair loss
generic lasix
JamesKnosy
lisinopril 10 mg cost: Buy Lisinopril 20 mg online – order lisinopril online
StanleyHelia
buy misoprostol over the counter cheapest cytotec Abortion pills online
StanleyHelia
nolvadex for pct buy tamoxifen citrate tamoxifen cost
DanielVum
buy cytotec pills https://tamoxifen.bid/# is nolvadex legal
lasix dosage
MichaelStorm
lipitor pill: buy atorvastatin online – cheap lipitor 20 mg https://lipitor.guru/# can i buy lipitor over the counter how to lose weight on tamoxifen tamoxifen benefits tamoxifen rash pictures
DanielVum
cytotec pills buy online https://tamoxifen.bid/# nolvadex for sale amazon
lasix online
StevenAcund
furosemida lasix 40 mg or lasix http://chat.inframonde.org/chat.php?s=furosemide.win lasix medication furosemide 40 mg furosemide and lasix 40 mg lasix generic name
Stephendup
https://lisinopril.guru/# lisinopril 80mg tablet
Stephendup
https://lipitor.guru/# lipitor 200 mg
WilliamBot
buy cytotec pills online cheap buy cytotec over the counter or buy cytotec over the counter https://www.google.ml/url?sa=t&url=http://cytotec.pro Abortion pills online cytotec abortion pill п»їcytotec pills online and cytotec online buy cytotec pills online cheap
ClaytonSmils
lisinopril 20mg pill drug lisinopril 5 mg or lisinopril 10mg tabs https://www.google.mg/url?sa=t&url=https://lisinopril.guru lisinopril 40 mg mexico 60 lisinopril cost lisinopril 20 mg purchase and lisinopril 20 mg pill 60 lisinopril cost
DanielVum
Abortion pills online https://tamoxifen.bid/# tamoxifen bone density
lasix 40mg
ClaytonSmils
lisinopril 10 lisinopril 40 mg best price or lisinopril tabs 10mg https://maps.google.be/url?sa=i&source=web&rct=j&url=https://lisinopril.guru buy lisinopril 20 mg online uk can i buy generic lisinopril online lisinopril 10 mg online and lisinopril 10 mg canada lisinopril 40mg
DanielVum
buy cytotec pills https://cytotec.pro/# Misoprostol 200 mg buy online
lasix for sale
JamesKnosy
п»їcytotec pills online: Misoprostol 200 mg buy online – buy cytotec over the counter
Stephendup
http://lipitor.guru/# lipitor 20 mg daily
MichaelStorm
buy cytotec online fast delivery: buy misoprostol tablet – п»їcytotec pills online https://lisinopril.guru/# lisinopril tabs 20mg generic lipitor price buy lipitor 20mg lipitor 40 mg cost
JamesKnosy
price of lipitor 40 mg: cheapest ace inhibitor – lipitor tablets
StanleyHelia
Abortion pills online cheapest cytotec Abortion pills online
hire an instagram hacker
Hello, Neat post. There is a problem along with your site in web explorer, would test this?K IE still is the marketplace chief and a huge portion of other folks will leave out your excellent writing due to this problem.
JamesKnosy
furosemide 40mg: cheap lasix – lasix 20 mg
DanielVum
Abortion pills online http://lisinopril.guru/# lisinopril 20 mg over the counter
lasix 100mg
JamesKnosy
furosemide 100mg: buy furosemide – lasix tablet
WilliamBot
cytotec buy online usa buy cytotec in usa or buy cytotec online fast delivery http://www.city-escort.net/url/?url=http://cytotec.pro Cytotec 200mcg price buy cytotec pills online cheap Abortion pills online and п»їcytotec pills online buy cytotec online
WilliamBot
cytotec abortion pill cytotec abortion pill or cytotec online https://www.google.sk/url?q=https://cytotec.pro cytotec buy online usa buy cytotec online cytotec abortion pill and buy cytotec online fast delivery buy cytotec over the counter
DanielVum
buy cytotec over the counter https://lipitor.guru/# lipitor canada price
lasix tablet
Stephendup
https://cytotec.pro/# order cytotec online
Stephendup
https://tamoxifen.bid/# tamoxifen postmenopausal
JamesKnosy
lipitor cost canada: buy atorvastatin online – lipitor 10mg price singapore
ClaytonSmils
lisinopril medicine zestoretic 20 25 mg or buy lisinopril 20 mg without a prescription https://images.google.ne/url?q=https://lisinopril.guru lisinopril 20 mg discount prinivil 10 mg tablet lisinopril generic price and lisinopril 40 mg for sale price of lisinopril 30 mg
MichaelStorm
lasix uses: furosemide online – furosemida https://lipitor.guru/# lipitor generic coupon lisinopril 10 mg tablet cost Lisinopril refill online zestoretic 20 12.5 mg
MichaelStorm
buy cytotec: cytotec best price – cytotec abortion pill https://furosemide.win/# lasix furosemide 40 mg tamoxifen bone density buy tamoxifen online tamoxifen and osteoporosis
ClaytonSmils
prinivil lisinopril 5 mg pill or cheapest price for lisinopril india http://mrg-sbyt.ru/bitrix/rk.php?goto=https://lisinopril.guru:: cost of prinivil buy cheap lisinopril prinivil 25 mg and zestoretic cost lisinopril 12.5 tablet
DanielVum
Misoprostol 200 mg buy online https://lisinopril.guru/# lisinopril 20 mg prices
furosemida 40 mg
JamesKnosy
lisinopril 40 mg for sale: cheap lisinopril – lisinopril buy in canada
Rvgcpu
neurontin 100mg uk – buy generic azulfidine azulfidine for sale online
Stephendup
https://cytotec.pro/# order cytotec online
Stephendup
http://lipitor.guru/# buy lipitor 40 mg
WilliamBot
buy cytotec over the counter Abortion pills online or buy cytotec online fast delivery https://www.google.me/url?q=https://cytotec.pro buy cytotec online fast delivery buy cytotec over the counter cytotec abortion pill and cytotec pills buy online Misoprostol 200 mg buy online
JamesKnosy
buy cytotec in usa: cheapest cytotec – order cytotec online
MichaelStorm
where can i get lisinopril: buy lisinopril – lisinopril 30 mg cost https://lisinopril.guru/# lisinopril 80mg cytotec abortion pill cytotec best price buy cytotec over the counter
MichaelStorm
tamoxifen chemo: buy tamoxifen online – tamoxifen estrogen https://furosemide.win/# lasix pills order cytotec online buy cytotec online buy cytotec pills
ClaytonSmils
lisinopril tab 100mg lisinopril 20mg prices or prinivil 20 mg tablet http://adamlewisschroeder.com/info.php?a=lisinopril online purchase lisinopril 10 mg without prescription and lisinopril online without prescription lisinopril 5 mg canada
JamesKnosy
cytotec abortion pill: cytotec best price – buy cytotec over the counter
ClaytonSmils
lisinopril tabs 10mg zestril cost or generic lisinopril 5 mg https://www.google.com.gt/url?q=https://lisinopril.guru lisinopril 10 mg for sale buy lisinopril online usa lisinopril without rx and lisinopril 5mg prices lisinopril 5 mg prices
JamesKnosy
lisinopril 10 mg price: Lisinopril online prescription – 10mg generic 10mg lisinopril
Vfwrcp
probenecid 500mg generic – etodolac 600 mg cheap tegretol buy online
WilliamBot
buy misoprostol over the counter cytotec abortion pill or cytotec buy online usa http://www.poputchik.ru/click.php?url=http://cytotec.pro/ Abortion pills online buy cytotec pills buy cytotec and п»їcytotec pills online buy cytotec in usa
MichaelStorm
buy cytotec in usa: buy cytotec online – buy cytotec over the counter https://furosemide.win/# lasix dosage alternative to tamoxifen Purchase Nolvadex Online buy tamoxifen
MichaelStorm
lipitor 10 mg tablet: buy lipitor 20mg – lipitor 40 mg price https://lipitor.guru/# lipitor generic price canada where to buy lisinopril without prescription price of zestril 30 mg order lisinopril online from canada
JamesKnosy
purchase cytotec: buy cytotec online – purchase cytotec
ClaytonSmils
prinivil 20 mg tablet lisinopril tablets for sale or lisinopril 40 mg price in india http://images.google.mv/url?q=https://lisinopril.guru lisinopril india price buy cheap lisinopril 40 mg no prescription buy lisinopril 2.5 mg and lisinopril cost uk online pharmacy lisinopril
ClaytonSmils
cheap lisinopril 40 mg zestril 10 mg in india or cost of lisinopril in canada https://maps.google.cd/url?q=https://lisinopril.guru zestoretic 10 12.5 buy lisinopril 5 mg can i buy lisinopril over the counter and zestril 5 mg india 50mg lisinopril
JamesKnosy
generic lipitor: buy atorvastatin online – buy lipitor
WilliamBot
Misoprostol 200 mg buy online Cytotec 200mcg price or buy cytotec over the counter https://maps.google.com.eg/url?q=https://cytotec.pro buy cytotec cytotec online Misoprostol 200 mg buy online and cytotec buy online usa Misoprostol 200 mg buy online
WilliamBot
buy cytotec over the counter buy cytotec pills online cheap or purchase cytotec https://maps.google.com.sb/url?sa=t&rct=j&url=https://cytotec.pro buy cytotec over the counter buy misoprostol over the counter п»їcytotec pills online and buy cytotec over the counter buy misoprostol over the counter
DanielVum
buy cytotec pills https://cytotec.pro/# Misoprostol 200 mg buy online
lasix 20 mg
JamesKnosy
how to get nolvadex: buy tamoxifen citrate – п»їdcis tamoxifen
MichaelStorm
zestril 40: zestoretic 20 25mg – lisinopril cost 5mg https://tamoxifen.bid/# tamoxifen premenopausal lasix generic buy furosemide lasix uses
MichaelStorm
lipitor online: cheapest ace inhibitor – buy lipitor online usa http://lipitor.guru/# brand name lipitor price buy cytotec pills cytotec best price buy cytotec in usa
JamesKnosy
lipitor generic brand name: Lipitor 10 mg price – lipitor canadian pharmacy
WilliamBot
buy cytotec pills online cheap cytotec pills buy online or cytotec online https://maps.google.gr/url?q=https://cytotec.pro buy cytotec online Cytotec 200mcg price cytotec pills buy online and п»їcytotec pills online order cytotec online
DanielVum
Abortion pills online https://cytotec.pro/# buy cytotec over the counter
furosemide 100 mg
ClaytonSmils
lisinopril 5 mg daily lisinopril 10 mg for sale or lisinopril 10 12.5 mg tablets http://www.google.com.ph/url?q=http://lisinopril.guru lisinopril 20 mg sale lisinopril 20 lisinopril 10 mg order online and lisinopril 10 mg over the counter lisinopril 40 mg daily
Robertdex
https://easyrxindia.shop/# india pharmacy
Peterrer
mexican border pharmacies shipping to usa: mexican pharmaceuticals online – buying prescription drugs in mexico online
Jeremykem
https://easyrxindia.com/# top 10 pharmacies in india
Jeremykem
https://easyrxcanada.com/# canadian pharmacy oxycodone
Robertdex
http://mexstarpharma.com/# reputable mexican pharmacies online
Hermannom
Online medicine home delivery: indian pharmacy online – world pharmacy india
Hermannom
medicine in mexico pharmacies: reputable mexican pharmacies online – mexican mail order pharmacies
Williamsoing
п»їbest mexican online pharmacies mexico pharmacies prescription drugs or mexico pharmacies prescription drugs https://www.google.com.uy/url?q=https://mexstarpharma.com mexico drug stores pharmacies medicine in mexico pharmacies best online pharmacies in mexico and mexican rx online medicine in mexico pharmacies
Jeremykem
http://easyrxindia.com/# indianpharmacy com
Jeremykem
https://easyrxindia.com/# indian pharmacy online
Danielemold
pharmacy website india reputable indian online pharmacy or india pharmacy http://www.lyes.tyc.edu.tw/dyna/webs/gotourl.php?url=https://easyrxindia.com best online pharmacy india top 10 online pharmacy in india buy prescription drugs from india and indian pharmacy paypal indian pharmacy
Danielemold
indian pharmacy paypal india pharmacy or indian pharmacy online http://www.1491.com.tw/phpinfo.php?a= best online pharmacy india indian pharmacy paypal online shopping pharmacy india and buy prescription drugs from india buy prescription drugs from india
Peterrer
online pharmacy india: cheapest online pharmacy india – indian pharmacy
Anthonytak
best india pharmacy indian pharmacy online buy prescription drugs from india
Robertdex
https://easyrxcanada.online/# canadian medications
Peterrer
cheap canadian pharmacy: safe online pharmacies in canada – canadian pharmacy
hire a hacker online
It’s really a nice and useful piece of information. I’m glad that you shared this useful info with us. Please keep us informed like this. Thanks for sharing.
Robertdex
https://easyrxcanada.online/# canadianpharmacyworld com
Hermannom
online pharmacy india: best india pharmacy – п»їlegitimate online pharmacies india
Hermannom
india pharmacy mail order: п»їlegitimate online pharmacies india – pharmacy website india
Jeremykem
https://easyrxindia.com/# indian pharmacy online
Jeremykem
https://easyrxindia.shop/# п»їlegitimate online pharmacies india
Peterrer
best online pharmacies in mexico: mexican rx online – п»їbest mexican online pharmacies
Williemar
canadian online drugs canadian pharmacy prices or buy canadian drugs http://images.google.co.uz/url?q=http://easyrxcanada.com canadian pharmacy antibiotics canadian drugs online the canadian pharmacy and canadian pharmacy northwest canadian pharmacy
Williamsoing
reputable mexican pharmacies online mexican border pharmacies shipping to usa or mexican border pharmacies shipping to usa https://todosobrelaesquizofrenia.com/Redirect/?url=https://mexstarpharma.com/ buying from online mexican pharmacy mexico drug stores pharmacies best online pharmacies in mexico and mexican rx online reputable mexican pharmacies online
Peterrer
best canadian pharmacy to buy from: canadian drugstore online – canadian pharmacy reviews
Robertdex
http://easyrxindia.com/# top online pharmacy india
Danielemold
Online medicine order buy prescription drugs from india or india online pharmacy http://chimesinternational.com/artists/sixties_gold/link.php?link=http://easyrxindia.com buy medicines online in india india pharmacy online pharmacy india and Online medicine order reputable indian online pharmacy
Cktwqr
buy colospa 135 mg pills – order arcoxia 120mg sale pletal 100 mg oral
Robertdex
https://mexstarpharma.com/# mexican online pharmacies prescription drugs
Jeremykem
https://easyrxcanada.online/# legit canadian online pharmacy
Jeremykem
https://easyrxindia.shop/# buy medicines online in india
Hermannom
indian pharmacies safe: mail order pharmacy india – indian pharmacy online
Hermannom
canadian online pharmacy: online canadian drugstore – canadian pharmacy prices
lottery defeater review
After study a few of the blog posts on your website now, and I truly like your way of blogging. I bookmarked it to my bookmark website list and will be checking back soon. Pls check out my web site as well and let me know what you think.
Vacjke
buy generic celebrex for sale – cheap generic flavoxate buy indocin without a prescription
Jesuscug
bonus veren siteler: deneme bonusu veren siteler – bonus veren siteler
DarrelTup
guvenilir slot siteleri 2024: yeni slot siteleri – en iyi slot siteleri 2024
Timothyzes
sweet bonanza sweet bonanza mostbet or sweet bonanza 100 tl https://cse.google.com.sg/url?q=https://sweetbonanza.network slot oyunlari sweet bonanza hilesi sweet bonanza and sweet bonanza 100 tl sweet bonanza demo
KevinFlome
https://sweetbonanza.network/# sweet bonanza oyna
KevinFlome
http://denemebonusuverensiteler.win/# bonus veren siteler
PercyWem
deneme bonusu: deneme bonusu veren siteler – bonus veren siteler https://slotsiteleri.bid/# en iyi slot siteleri deneme bonusu veren siteler deneme bonusu bahis siteleri
Leonarddup
guncel sweet bonanza: sweet bonanza oyna – sweet bonanza yasal site http://sweetbonanza.network/# sweet bonanza slot
DarrelTup
deneme bonusu veren slot siteleri: slot casino siteleri – en iyi slot siteler
PercyWem
slot siteleri 2024: guvenilir slot siteleri 2024 – casino slot siteleri https://slotsiteleri.bid/# slot kumar siteleri sweet bonanza taktik sweet bonanza guncel sweet bonanza oyna
Jesuscug
slot siteleri: guvenilir slot siteleri – en cok kazandiran slot siteleri
Leonarddup
en iyi slot siteler: slot siteleri bonus veren – en guvenilir slot siteleri http://denemebonusuverensiteler.win/# deneme bonusu
tonic greens
Excellent read, I just passed this onto a colleague who was doing some research on that. And he just bought me lunch since I found it for him smile Therefore let me rephrase that: Thank you for lunch! “Remember It is 10 times harder to command the ear than to catch the eye.” by Duncan Maxwell Anderson.
boostaro
Just wanna comment that you have a very decent site, I enjoy the layout it actually stands out.
tonic greens
Your house is valueble for me. Thanks!…
prodentim review
Hi there, just become alert to your weblog thru Google, and located that it’s really informative. I am gonna be careful for brussels. I will be grateful in the event you proceed this in future. Many people can be benefited from your writing. Cheers!
Leonarddup
bonus veren siteler: bonus veren siteler – deneme bonusu http://denemebonusuverensiteler.win/# deneme bonusu
PercyWem
bonus veren siteler: deneme bonusu veren siteler – bahis siteleri https://denemebonusuverensiteler.win/# bahis siteleri bonus veren siteler bahis siteleri deneme bonusu veren siteler
KevinFlome
https://sweetbonanza.network/# sweet bonanza bahis
KevinFlome
https://slotsiteleri.bid/# en iyi slot siteleri 2024
Leonarddup
deneme bonusu veren siteler: bahis siteleri – bonus veren siteler http://sweetbonanza.network/# sweet bonanza giris
Zwbxyc
order voltaren 100mg online cheap – cambia drug buy aspirin online cheap
DarrelTup
en iyi slot siteler: slot siteleri guvenilir – slot bahis siteleri
Leonarddup
slot siteleri guvenilir: oyun siteleri slot – slot bahis siteleri http://denemebonusuverensiteler.win/# bonus veren siteler
PercyWem
slot siteleri 2024: deneme veren slot siteleri – slot casino siteleri http://slotsiteleri.bid/# deneme bonusu veren slot siteleri sweet bonanza yasal site pragmatic play sweet bonanza sweet bonanza nas?l oynan?r
DarrelTup
slot siteleri bonus veren: slot kumar siteleri – yeni slot siteleri
PercyWem
deneme bonusu veren siteler: deneme bonusu veren siteler – bonus veren siteler http://sweetbonanza.network/# sweet bonanza bahis deneme bonusu deneme bonusu veren siteler deneme bonusu
KevinFlome
https://slotsiteleri.bid/# canl? slot siteleri
KevinFlome
https://sweetbonanza.network/# sweet bonanza free spin demo
PercyWem
sweet bonanza taktik: sweet bonanza oyna – sweet bonanza slot demo http://sweetbonanza.network/# sweet bonanza slot deneme bonusu deneme bonusu veren siteler bahis siteleri
KevinFlome
http://slotsiteleri.bid/# deneme veren slot siteleri
KevinFlome
https://denemebonusuverensiteler.win/# bonus veren siteler
PercyWem
sweet bonanza 100 tl: sweet bonanza free spin demo – sweet bonanza nas?l oynan?r http://denemebonusuverensiteler.win/# deneme bonusu bonus veren slot siteleri slot kumar siteleri yeni slot siteleri
ShannonHef
bahis siteleri bahis siteleri or deneme bonusu veren siteler http://italianculture.net/redir.php?url=http://denemebonusuverensiteler.win/ deneme bonusu bonus veren siteler bonus veren siteler and deneme bonusu veren siteler bahis siteleri
Timothyzes
sweet bonanza bahis sweet bonanza nas?l oynan?r or guncel sweet bonanza https://toolbarqueries.google.com.nf/url?sa=t&url=https://sweetbonanza.network sweet bonanza free spin demo sweet bonanza demo oyna sweet bonanza demo oyna and sweet bonanza bahis sweet bonanza giris
Timothyzes
sweet bonanza demo oyna sweet bonanza 100 tl or sweet bonanza slot demo https://clients1.google.lu/url?q=https://sweetbonanza.network sweet bonanza yorumlar sweet bonanza bahis sweet bonanza yasal site and sweet bonanza taktik sweet bonanza free spin demo
PercyWem
bahis siteleri: bahis siteleri – deneme bonusu https://sweetbonanza.network/# sweet bonanza yorumlar en guvenilir slot siteleri slot siteleri bonus veren guvenilir slot siteleri 2024
PercyWem
deneme bonusu veren siteler: deneme bonusu veren siteler – deneme bonusu https://denemebonusuverensiteler.win/# deneme bonusu deneme bonusu deneme bonusu bonus veren siteler
DarrelTup
guvenilir slot siteleri: en iyi slot siteleri – slot oyunlar? siteleri
ShannonHef
deneme bonusu veren siteler bahis siteleri or deneme bonusu veren siteler https://www.textise.net/showText.aspx?strURL=http://denemebonusuverensiteler.win deneme bonusu veren siteler bonus veren siteler bonus veren siteler and bahis siteleri bonus veren siteler
KevinFlome
http://denemebonusuverensiteler.win/# deneme bonusu veren siteler
ShannonHef
deneme bonusu veren siteler deneme bonusu veren siteler or bahis siteleri https://images.google.gm/url?sa=t&url=https://denemebonusuverensiteler.win bonus veren siteler bonus veren siteler deneme bonusu and deneme bonusu deneme bonusu
Leonarddup
bahis siteleri: deneme bonusu veren siteler – bahis siteleri http://denemebonusuverensiteler.win/# bonus veren siteler
DarrelTup
deneme bonusu veren siteler: en yeni slot siteleri – slot siteleri bonus veren
Timothyzes
sweet bonanza giris sweet bonanza yasal site or sweet bonanza demo https://www.google.co.kr/url?sa=t&url=https://sweetbonanza.network sweet bonanza kazanma saatleri sweet bonanza 100 tl sweet bonanza siteleri and sweet bonanza giris sweet bonanza hilesi
Zltkuv
rumalaya online – oral rumalaya endep drug
RobertFible
1xbet скачать: 1xbet официальный сайт – 1xbet зеркало рабочее на сегодня http://pin-up.diy/# pin up пин ап казино вход пинап казино pin up
hire a hacker for facebook
Hello, you used to write fantastic, but the last few posts have been kinda boringK I miss your super writings. Past few posts are just a bit out of track! come on!
Warrenhok
http://vavada.auction/# vavada зеркало
Warrenhok
http://1win.directory/# 1вин сайт
Scottmoogs
пин ап вход: пин ап зеркало – пин ап вход
Scottmoogs
пин ап зеркало: пин ап вход – пин ап казино вход
crisis management
Woah! I’m really loving the template/theme of this blog. It’s simple, yet effective. A lot of times it’s hard to get that “perfect balance” between user friendliness and appearance. I must say you’ve done a superb job with this. Additionally, the blog loads very quick for me on Safari. Outstanding Blog!
kidnap and ransom
Loving the info on this internet site, you have done outstanding job on the content.
LeslieCag
1хбет зеркало 1xbet зеркало рабочее на сегодня 1xbet скачать
LeslieCag
казино вавада vavada casino вавада
ScottCoste
вавада казино: вавада рабочее зеркало – вавада рабочее зеркало
Scottmoogs
pin up: пин ап зеркало – pin up
JosephEpimi
1xbet скачать зеркало 1хбет or 1хбет зеркало https://cse.google.com.sv/url?q=https://1xbet.contact зеркало 1хбет 1xbet официальный сайт мобильная версия 1xbet зеркало рабочее на сегодня and 1xbet скачать 1хбет зеркало
ScottCoste
1win зеркало: 1win зеркало – 1win вход
JosephEpimi
1хбет зеркало 1xbet официальный сайт or 1xbet официальный сайт http://clients1.google.nu/url?q=https://1xbet.contact 1xbet зеркало 1xbet 1xbet скачать and 1xbet 1хбет
Warrenhok
http://1xbet.contact/# 1xbet зеркало рабочее на сегодня
Warrenhok
http://pin-up.diy/# пин ап казино вход
ScottCoste
pin up: пин ап казино – pin up casino
RobertVam
вавада vavada казино or вавада рабочее зеркало https://images.google.com.ai/url?sa=t&url=https://vavada.auction вавада рабочее зеркало vavada вавада рабочее зеркало and казино вавада вавада казино
Warrenhok
https://vavada.auction/# вавада зеркало
Warrenhok
http://vavada.auction/# вавада зеркало
ScottCoste
1xbet скачать: 1хбет официальный сайт – 1хбет официальный сайт
RobertVam
vavada online casino вавада рабочее зеркало or вавада казино https://lehrter.reisen/redirect/index.asp?url=http://vavada.auction vavada казино vavada казино вавада зеркало and вавада зеркало vavada online casino
ScottCoste
1вин: 1вин – 1win
Victorfurgy
ван вин 1вин официальный сайт or 1вин зеркало http://www.poputchik.ru/click.php?url=http://1win.directory/ ван вин 1вин зеркало 1win официальный сайт and 1win вход 1вин зеркало
ScottCoste
вавада зеркало: vavada казино – vavada казино
Victorfurgy
1вин сайт ван вин or 1вин зеркало http://www.esquiremediakit.com/r5/emaillink.asp?link=https://1win.directory:: 1win вход 1вин сайт ван вин and 1вин 1win вход
RobertVam
vavada вавада казино or vavada casino http://sfmission.com/rss/feed2js.php?src=http://vavada.auction вавада зеркало вавада казино вавада казино and вавада казино вавада
Victorfurgy
1win вход 1win официальный сайт or ван вин https://cse.google.es/url?sa=i&url=http://1win.directory 1вин сайт ван вин 1win вход and 1win 1win зеркало
OllieDaync
https://drstore24.com/# compounding pharmacy synthroid ed pills online peoples pharmacy wellbutrin xl pharmacy online levitra
PharmSaw
gastro health: mexican pharmacy lexapro – lexapro pharmacy coupon https://easydrugrx.com/# envision rx pharmacy locator generic viagra online pharmacy cheapest viagra online pharmacy thailand pharmacy viagra
Drstounike
motilium inhouse pharmacy: best indian pharmacy online – rite aid 24 hour pharmacy store locator
Drstounike
warfarin audit pharmacy: prevacid online pharmacy – provigil pharmacy prices
Jeffreyorala
https://pharm24on.com/# kroger online pharmacy
veterans online pharmacy
PharmSaw
compounding pharmacy: online pharmacies – safeway pharmacy methotrexate error https://easydrugrx.com/# Viagra Oral Jelly online pharmacy viagra usa lortab online pharmacy h-e-b pharmacy
Jeffreyorala
https://onlineph24.com/# online pharmacy clobetasol
wellbutrin xl online pharmacy
PharmSaw
provigil overseas pharmacy: venlafaxine xr online pharmacy – india pharmacy ambien https://pharm24on.com/# pharmacy mall legit online pharmacy nolvadex over the counter online pharmacy online pharmacy viagra review
PharmSaw
do pharmacy sell viagra: smith’s pharmacy – buy cialis online us pharmacy https://pharm24on.com/# eckerd pharmacy store locator risperdal online pharmacy kamagra pharmacy online meloxicam pharmacy
Jeffreyorala
https://drstore24.com/# klonopin online pharmacy reviews
handling methotrexate in pharmacy
Drstounike
online pharmacy azithromycin: itraconazole pharmacy – savon pharmacy
Drstounike
levofloxacin online pharmacy: neighbor rx pharmacy – doxepin pharmacy
PharmSaw
propecia generic online pharmacy: giant food store phoenixville pharmacy – pharmacy online store https://easydrugrx.com/# Female Viagra weight loss real viagra online pharmacy national pharmacies
ThomasWet
cephalexin online pharmacy united pharmacy proscar or european pharmacy cialis https://www.google.bt/url?sa=t&url=https://drstore24.com percocet overseas pharmacy online pharmacy viagra australia viagra cost at pharmacy and good neighbor pharmacy ibuprofen ventolin uk pharmacy
OllieDaync
https://onlineph24.com/# pharmacy direct gabapentin generic cialis pharmacy online cialis online review online pharmacy klonopin pharmacy price
PharmSaw
lorazepam pharmacy: levitra pharmacy price – professional pharmacy https://pharm24on.com/# navarro pharmacy lamotrigine pharmacy 24 hours pharmacy store omeprazole pharmacy only
OllieDaync
https://onlineph24.com/# pharmacy delivery online pharmacy acyclovir Ventolin cialis american pharmacy
Jeffreyorala
https://onlineph24.com/# mail order pharmacy viagra
target pharmacy warfarin
PharmSaw
mexican pharmacy percocet: online pharmacy permethrin – mail order pharmacy https://onlineph24.com/# doxycycline hyclate online pharmacy target pharmacy ventolin online mail order pharmacy rxmedico online pharmacy
Jeffreyorala
https://pharm24on.com/# unicare pharmacy artane
allegra at kaiser pharmacy
EasydrSat
detrol la online pharmacy: generic viagra online pharmacy india – misoprostol pharmacy cost
Drstounike
misoprostol at pharmacy: pharmacy online tadalafil – Cefixime
Drstounike
pharmacy online degrees: mexican pharmacy cipro – the best online pharmacy
EasydrSat
publix pharmacy free lisinopril: Dulcolax – sumatriptan uk pharmacy
PharmSaw
bactrim uk pharmacy: meloxicam target pharmacy – best pharmacy price on viagra https://easydrugrx.com/# online pharmacy services viagra canadien pharmacies steroid online pharmacy optimal rx pharmacy
OllieDaync
https://onlineph24.com/# coumadin pharmacy permethrin cream online pharmacy brazilian pharmacy online military pharmacy viagra
HomerloM
india pharmacy online pharmacy online usa or prices pharmacy https://maps.google.bj/url?q=https://onlineph24.com cialis online review online pharmacy clozapine online pharmacy pharmacy online program and Imuran online pharmacy prozac no prescription
ThomasWet
uk pharmacy online viagra online overseas pharmacy or best online pharmacy stores https://www.google.com.bz/url?q=https://drstore24.com purchase adipex from an online pharmacy online pharmacy tamoxifen Cipro and viagra pharmacy reviews Tofranil
PharmSaw
aarp medicare rx pharmacy directory: pharmacy2u co uk viagra – Singulair https://drstore24.com/# mental illness kamagra pharmacy uk propranolol online pharmacy skip’s pharmacy low dose naltrexone
Drstounike
wegmans online pharmacy: northwest pharmacy – nexium pharmacy prices
Drstounike
kmart pharmacy: meijer pharmacy amoxicillin – reliable rx pharmacy coupon code
HomerloM
nizoral shampoo pharmacy testosterone cypionate online pharmacy or neoral pharmacy http://maps.google.fi/url?q=https://onlineph24.com albendazole online pharmacy online pharmacy no prescription total rx pharmacy and call in percocet to pharmacy permethrin online pharmacy
EasydrSat
boots pharmacy uk viagra: bahrain pharmacy cialis – pharmacy global rx review
EasydrSat
Celexa: online pharmacy india viagra – value rx pharmacy
OllieDaync
https://easydrugrx.com/# viagra generic pharmacy viagra offshore pharmacy united healthcare online pharmacy prednisone online pharmacy
OllieDaync
https://drstore24.com/# fanda pharmacy hong kong cialis skin care online pharmacy sildenafil 100mg adipex online us pharmacy
PharmSaw
cefixime online pharmacy: contact your pharmacy to fill this rx – flomax pharmacy training https://easydrugrx.com/# amar pharmacy rx rite aid pharmacy allegra bm pharmacy accutane discount rx pharmacy
EasydrSat
effexor xr pharmacy: discount pharmacy mexico – viagra discount pharmacy
PharmSaw
meds online pharmacy: klonopin online pharmacy no prescription – cabergoline overseas pharmacy https://easydrugrx.com/# inhouse pharmacy proscar cialis us pharmacy best rated online pharmacy frys food store pharmacy hours
Drstounike
atarax online pharmacy: clomid pharmacy – seroquel xr online pharmacy
Drstounike
lansoprazole pharmacy: reliable rx pharmacy review – motilium new zealand pharmacy
EasydrSat
generic zoloft online pharmacy no prescription: pharmacy artane – online pharmacy same day delivery
Xjjkee
voveran online order – buy diclofenac sale nimodipine order
HomerloM
sainsburys pharmacy viagra target pharmacy montelukast or pharmacy near me https://cse.google.gr/url?sa=t&url=https://onlineph24.com peoples pharmacy lisinopril inhouse pharmacy spironolactone online pharmacy coupon and xalatan pharmacy nizoral boots pharmacy
RobertJarly
buying prescription drugs in mexico online: best online pharmacies in mexico – pharmacies in mexico that ship to usa
JamesHor
indian pharmacy: top 10 pharmacies in india – world pharmacy india http://indianpharmacy.company/# mail order pharmacy india
Mauriceirons
buy viagra online us pharmacy: pills viagra pharmacy 100mg – guardian pharmacy viagra
ArthurTaili
http://indianpharmacy.company/# Online medicine home delivery
ArthurTaili
https://indianpharmacy.company/# reputable indian online pharmacy
Josephgok
lortab online pharmacy online pharmacy viagra us atarax online pharmacy
Mauriceirons
best online pharmacy to get viagra: reliable online pharmacy – pharmacy discount card rx relief
RobertJarly
mexican border pharmacies shipping to usa: mexican mail order pharmacies – best online pharmacies in mexico
DavidSam
online pharmacy united states pharmacy prescription or keflex online pharmacy https://cse.google.com.br/url?sa=t&url=https://pharmbig24.com concerta online pharmacy online pharmacy lorazepam ibuprofen singapore pharmacy and family mart store online pharmacy fluconazole mexico pharmacy
JamesHor
mexican pharmaceuticals online: reputable mexican pharmacies online – п»їbest mexican online pharmacies https://mexicopharmacy.cheap/# п»їbest mexican online pharmacies
Mauriceirons
online pharmacy india: indian pharmacy online – india online pharmacy
RobertJarly
reputable indian online pharmacy: top 10 pharmacies in india – mail order pharmacy india
JamesHor
india online pharmacy: online pharmacy india – mail order pharmacy india https://pharmbig24.com/# pharmacy rx one order status
CharlesSnank
mexican border pharmacies shipping to usa purple pharmacy mexico price list or reputable mexican pharmacies online http://nou-rau.uem.br/nou-rau/zeus/register.php?back=https://mexicopharmacy.cheap п»їbest mexican online pharmacies п»їbest mexican online pharmacies purple pharmacy mexico price list and п»їbest mexican online pharmacies pharmacies in mexico that ship to usa
RobertJarly
Online medicine home delivery: п»їlegitimate online pharmacies india – india pharmacy
Bryantdok
mexican rx online mexican online pharmacies prescription drugs or mexico drug stores pharmacies https://www.telltrail.com/profile/leaving-our-protection?url=https://mexicopharmacy.cheap medicine in mexico pharmacies п»їbest mexican online pharmacies pharmacies in mexico that ship to usa and mexican mail order pharmacies mexico drug stores pharmacies
Josephgok
costa rica pharmacy viagra viagra vipps pharmacy Atorlip-10
ArthurTaili
https://mexicopharmacy.cheap/# buying from online mexican pharmacy
ArthurTaili
https://pharmbig24.online/# viagra european pharmacy
JamesHor
indian pharmacy: top online pharmacy india – top online pharmacy india http://indianpharmacy.company/# п»їlegitimate online pharmacies india
RobertJarly
buying from online mexican pharmacy: pharmacies in mexico that ship to usa – mexico drug stores pharmacies
Robertspima
indianpharmacy com top 10 online pharmacy in india or reputable indian pharmacies https://secure.aos.org/login.aspx?returnurl=http://indianpharmacy.company/ online shopping pharmacy india india pharmacy mail order reputable indian pharmacies and indianpharmacy com india pharmacy
Mauriceirons
medication from mexico pharmacy: п»їbest mexican online pharmacies – mexico pharmacies prescription drugs
Robertspima
buy medicines online in india online shopping pharmacy india or world pharmacy india http://cse.google.bj/url?sa=i&url=http://indianpharmacy.company online shopping pharmacy india pharmacy website india online shopping pharmacy india and indian pharmacy online п»їlegitimate online pharmacies india
JamesHor
online shopping pharmacy india: buy medicines online in india – online pharmacy india http://indianpharmacy.company/# Online medicine home delivery
Josephgok
buy ambien us pharmacy sams club pharmacy viagra price online mexico pharmacy
JamesHor
online shopping pharmacy india: indian pharmacy – world pharmacy india http://mexicopharmacy.cheap/# medicine in mexico pharmacies
DavidSam
bradley pharmacy artane online pharmacy cheap cialis or rx options pharmacy help desk https://cse.google.com.ua/url?sa=t&url=https://pharmbig24.com percocet online no prescription pharmacy pharmacy online shopping no prescription needed pharmacy and Ventolin wedgewood pharmacy flagyl
curso de especializacion en inteligencia artificial y big data
You need to participate in a contest for among the best blogs on the web. I will advocate this web site!
keep doing
great put up, very informative. I wonder why the opposite experts of this sector don’t realize this. You should continue your writing. I am sure, you’ve a huge readers’ base already!
ArthurTaili
https://mexicopharmacy.cheap/# mexico drug stores pharmacies
ArthurTaili
http://mexicopharmacy.cheap/# buying prescription drugs in mexico
Josephgok
pharmacy website india indian pharmacy online online shopping pharmacy india
videopad video editing software
You are a very intelligent individual!
Mauriceirons
mexico drug stores pharmacies: reputable mexican pharmacies online – mexican border pharmacies shipping to usa
JamesHor
india pharmacy mail order: buy prescription drugs from india – buy medicines online in india https://pharmbig24.online/# jamaica rx pharmacy
Josephgok
is world pharmacy store legit domperidone new zealand pharmacy xenical online pharmacy india
Bryantdok
mexican border pharmacies shipping to usa medicine in mexico pharmacies or mexican pharmaceuticals online http://www.gensuikin.org/i/index.cgi?id=1&mode=redirect&no=242&ref_eid=110&url=http://mexicopharmacy.cheap mexico drug stores pharmacies medicine in mexico pharmacies purple pharmacy mexico price list and mexico drug stores pharmacies mexico pharmacies prescription drugs
Bryantdok
medication from mexico pharmacy medicine in mexico pharmacies or reputable mexican pharmacies online https://clients1.google.com.eg/url?q=https://mexicopharmacy.cheap mexican rx online medication from mexico pharmacy pharmacies in mexico that ship to usa and buying prescription drugs in mexico online medication from mexico pharmacy
JamesHor
online pharmacy no presc: homeopathic pharmacy online – medco pharmacy cialis https://mexicopharmacy.cheap/# pharmacies in mexico that ship to usa
RobertJarly
indian pharmacies safe: compare rx prices – simvastatin online pharmacy
Josephgok
Online medicine order best india pharmacy india pharmacy
Robertspima
indian pharmacy best india pharmacy or indian pharmacies safe http://cse.google.co.ke/url?sa=i&url=http://indianpharmacy.company buy medicines online in india top online pharmacy india best india pharmacy and п»їlegitimate online pharmacies india online shopping pharmacy india
DavidSam
online pharmacy ventolin amoxicillin pharmacy price or singapore pharmacy online store https://image.google.vg/url?sa=i&rct=j&url=https://pharmbig24.com klonopin online pharmacy reviews g and e pharmacy edmonton store hours best online pharmacy adipex and rx warehouse pharmacy online pharmacy sildenafil 100mg
JamesHor
mexican mail order pharmacies: best online pharmacies in mexico – mexican online pharmacies prescription drugs https://mexicopharmacy.cheap/# medicine in mexico pharmacies
ArthurTaili
https://indianpharmacy.company/# online shopping pharmacy india
Josephgok
mexican drugstore online medication from mexico pharmacy buying from online mexican pharmacy
Mauriceirons
fluoxetine pharmacy: vet pharmacy online – sky pharmacy
JamesHor
india pharmacy mail order: top 10 online pharmacy in india – top 10 pharmacies in india https://indianpharmacy.company/# india pharmacy
RobertJarly
india online pharmacy: best india pharmacy – indian pharmacy
Josephgok
buy medicines online in india india pharmacy online pharmacy india
DavidSam
schedule rx pharmacy one source drug stores near me or online pharmacy paroxetine https://toolbarqueries.google.ml/url?q=http://pharmbig24.com us pharmacy viagra no prescription pharmacy online program cialis generic online pharmacy and tesco pharmacy zovirax stat rx pharmacy
Mauriceirons
online shopping pharmacy india: reputable indian online pharmacy – best online pharmacy india
Josephgok
п»їbest mexican online pharmacies mexican border pharmacies shipping to usa mexican border pharmacies shipping to usa
JamesHor
gabapentin pharmacy prices: online pharmacy reviews viagra – mens ed pills https://mexicopharmacy.cheap/# mexican mail order pharmacies
Bryantdok
mexican drugstore online reputable mexican pharmacies online or reputable mexican pharmacies online https://image.google.je/url?q=https://mexicopharmacy.cheap buying from online mexican pharmacy purple pharmacy mexico price list buying prescription drugs in mexico online and buying from online mexican pharmacy mexican rx online
Bryantdok
best online pharmacies in mexico mexican border pharmacies shipping to usa or medicine in mexico pharmacies https://www.google.com.pr/url?q=http://mexicopharmacy.cheap mexican pharmaceuticals online mexican rx online medicine in mexico pharmacies and mexican pharmaceuticals online medication from mexico pharmacy
ArthurTaili
https://indianpharmacy.company/# best india pharmacy
ArthurTaili
https://indianpharmacy.company/# Online medicine order
JamesHor
augmentin pharmacy prices: thailand pharmacy ambien – rx unlimited pharmacy http://pharmbig24.com/# drug rx
RobertJarly
indian pharmacy: india pharmacy – online shopping pharmacy india
CharlesSnank
mexican online pharmacies prescription drugs buying prescription drugs in mexico online or buying from online mexican pharmacy https://toolbarqueries.google.com.ni/url?sa=i&url=http://mexicopharmacy.cheap best online pharmacies in mexico mexican pharmaceuticals online п»їbest mexican online pharmacies and mexican pharmaceuticals online best online pharmacies in mexico
Josephgok
panadol pharmacy bachelor of pharmacy online pharmacy cialis viagra
JamesHor
pharmacies in mexico that ship to usa: buying prescription drugs in mexico – mexican online pharmacies prescription drugs https://indianpharmacy.company/# top online pharmacy india
Robertspima
reputable indian pharmacies reputable indian online pharmacy or top 10 online pharmacy in india http://www.boostersite.es/votar-4378-4270.html?adresse=indianpharmacy.company& top online pharmacy india world pharmacy india Online medicine order and indian pharmacy top online pharmacy india
The Money Wave
It is in point of fact a nice and useful piece of information. I am happy that you simply shared this useful info with us. Please keep us informed like this. Thanks for sharing.
Mauriceirons
depakote er online pharmacy: Aristocort – people’s pharmacy zyrtec
RobertJarly
lortab refills pharmacy: cost of viagra at pharmacy – mexican pharmacy doxycycline
Robertspima
top online pharmacy india top 10 online pharmacy in india or top 10 pharmacies in india http://www.victoirefrance.fr/expire.aspx?Returnurl=https://indianpharmacy.company/ india pharmacy indianpharmacy com buy prescription drugs from india and online pharmacy india reputable indian online pharmacy
JamesHor
medicine in mexico pharmacies: best online pharmacies in mexico – best online pharmacies in mexico https://pharmbig24.online/# online pharmacy atorvastatin
Josephgok
methotrexate audit pharmacy acyclovir uk pharmacy online pharmacies no prescription
Mauriceirons
online shopping pharmacy india: indian pharmacy – world pharmacy india
ArthurTaili
https://mexicopharmacy.cheap/# best online pharmacies in mexico
Josephgok
best online pharmacies in mexico mexican border pharmacies shipping to usa mexican border pharmacies shipping to usa
JamesHor
buying from online mexican pharmacy: mexican online pharmacies prescription drugs – mexican drugstore online http://mexicopharmacy.cheap/# best online pharmacies in mexico
CharlesSnank
mexico drug stores pharmacies mexico drug stores pharmacies or buying prescription drugs in mexico https://www.crucible-technologies.co.uk/registrationcomplete.aspx?returnurl=https://mexicopharmacy.cheap mexico drug stores pharmacies mexican online pharmacies prescription drugs mexican border pharmacies shipping to usa and buying prescription drugs in mexico mexican online pharmacies prescription drugs
RobertJarly
best online pharmacies in mexico: mexico pharmacies prescription drugs – buying from online mexican pharmacy
Bryantdok
buying prescription drugs in mexico mexican pharmaceuticals online or medication from mexico pharmacy https://images.google.bi/url?q=https://mexicopharmacy.cheap mexican mail order pharmacies mexican drugstore online medication from mexico pharmacy and buying from online mexican pharmacy mexico drug stores pharmacies
Bryantdok
medication from mexico pharmacy mexico drug stores pharmacies or mexico pharmacies prescription drugs http://maps.google.is/url?q=http://mexicopharmacy.cheap mexican mail order pharmacies medicine in mexico pharmacies buying prescription drugs in mexico and mexican mail order pharmacies best online pharmacies in mexico
JamesHor
buy medicines online in india: top online pharmacy india – online shopping pharmacy india https://indianpharmacy.company/# top 10 pharmacies in india
Mauriceirons
mexican border pharmacies shipping to usa: buying prescription drugs in mexico online – mexican border pharmacies shipping to usa
RobertJarly
best rx pharmacy: viagra from vipps pharmacy – Kamagra Effervescent
Hqqmjv
baclofen 25mg generic – piroxicam 20 mg generic feldene 20mg ca
Josephgok
india online pharmacy indian pharmacy paypal best online pharmacy india
Mauriceirons
top 10 pharmacies in india: online shopping pharmacy india – indian pharmacy paypal
JamesHor
indian pharmacy online: indianpharmacy com – top online pharmacy india http://indianpharmacy.company/# best online pharmacy india
ArthurTaili
https://pharmbig24.com/# ambien cr online pharmacy
ArthurTaili
https://pharmbig24.online/# aetna rx pharmacy
RobertJarly
buying from online mexican pharmacy: purple pharmacy mexico price list – mexican drugstore online
Robertspima
best india pharmacy cheapest online pharmacy india or pharmacy website india http://www.schmooz.de/redirect/?url=http://indianpharmacy.company reputable indian pharmacies buy medicines online in india mail order pharmacy india and reputable indian online pharmacy indianpharmacy com
DavidSam
pharmacy shop online strattera indian pharmacy or seconal online pharmacy http://naiyoujc.ff66.net/productshow.asp?id=30&mnid=51913&url=http://pharmbig24.com no prescription pharmacies rx clinic pharmacy charlotte nc best pharmacy to buy cialis and Lotrisone target pharmacy lipitor price
JamesHor
Methocarbamol: pharmacy programs online – Female Viagra https://pharmbig24.online/# pharmacy
Josephgok
purple pharmacy mexico price list buying prescription drugs in mexico online mexican drugstore online
RobertJarly
top 10 online pharmacy in india: india pharmacy – indian pharmacy paypal
Robertspima
best india pharmacy best india pharmacy or indian pharmacy paypal https://images.google.bs/url?sa=t&url=https://indianpharmacy.company reputable indian pharmacies indian pharmacy online buy medicines online in india and top 10 online pharmacy in india best india pharmacy
Mauriceirons
mexican mail order pharmacies: buying prescription drugs in mexico online – mexico pharmacies prescription drugs
Josephgok
п»їlegitimate online pharmacies india online pharmacy india indian pharmacy
JamesHor
mexico pharmacies prescription drugs: mexican border pharmacies shipping to usa – buying prescription drugs in mexico http://indianpharmacy.company/# buy medicines online in india
RobertJarly
indianpharmacy com: indian pharmacy – mail order pharmacy india
CharlesSnank
mexican pharmaceuticals online п»їbest mexican online pharmacies or medication from mexico pharmacy https://clients1.google.com.pg/url?q=https://mexicopharmacy.cheap best online pharmacies in mexico mexican border pharmacies shipping to usa mexico pharmacies prescription drugs and п»їbest mexican online pharmacies buying from online mexican pharmacy
Mauriceirons
best india pharmacy: reputable indian online pharmacy – online pharmacy india
Bryantdok
purple pharmacy mexico price list purple pharmacy mexico price list or buying prescription drugs in mexico https://www.google.com.jm/url?sa=t&url=https://mexicopharmacy.cheap best online pharmacies in mexico buying prescription drugs in mexico online mexican border pharmacies shipping to usa and mexico drug stores pharmacies buying prescription drugs in mexico online
Bryantdok
buying prescription drugs in mexico online medication from mexico pharmacy or buying prescription drugs in mexico http://7ba.org/out.php?url=https://mexicopharmacy.cheap mexican pharmaceuticals online mexico drug stores pharmacies mexican pharmaceuticals online and п»їbest mexican online pharmacies mexico drug stores pharmacies
Josephgok
mexico drug stores pharmacies mexican border pharmacies shipping to usa mexico pharmacies prescription drugs
RobertJarly
reputable indian pharmacies: Online medicine order – п»їlegitimate online pharmacies india
JamesHor
indian pharmacy: п»їlegitimate online pharmacies india – Online medicine order https://pharmbig24.online/# online pharmacy reviews provigil
ArthurTaili
http://mexicopharmacy.cheap/# mexican online pharmacies prescription drugs
ArthurTaili
http://mexicopharmacy.cheap/# buying from online mexican pharmacy
Josephgok
top online pharmacy india reputable indian pharmacies indianpharmacy com
RobertJarly
indian pharmacy: reputable indian online pharmacy – best online pharmacy india
Mauriceirons
cialis xlpharmacy: target pharmacy zocor – best online pharmacy accutane
Josephgok
xenical singapore pharmacy how much does viagra cost at a pharmacy diovan pharmacy coupons
RobertJarly
best india pharmacy: indian pharmacy paypal – Online medicine home delivery
CharlesSnank
purple pharmacy mexico price list buying prescription drugs in mexico online or mexican online pharmacies prescription drugs https://images.google.com.py/url?q=https://mexicopharmacy.cheap mexico drug stores pharmacies best online pharmacies in mexico purple pharmacy mexico price list and medicine in mexico pharmacies buying from online mexican pharmacy
JamesHor
mexican mail order pharmacies: mexico drug stores pharmacies – mexican pharmaceuticals online http://indianpharmacy.company/# indian pharmacies safe
Robertspima
top online pharmacy india india pharmacy or best online pharmacy india https://maps.google.ie/url?sa=t&url=https://indianpharmacy.company buy prescription drugs from india world pharmacy india buy prescription drugs from india and india online pharmacy indianpharmacy com
DavidSam
pharmacy world rx pharmacy warfarin counselling or prozac indian pharmacy http://www.allbeaches.net/goframe.cfm?site=http://pharmbig24.com dog pharmacy online cialis super active online pharmacy generic lexapro online pharmacy and pharmacy online india safeway online pharmacy
Josephgok
mexican rx online buying prescription drugs in mexico online mexico drug stores pharmacies
Robertspima
india online pharmacy buy prescription drugs from india or cheapest online pharmacy india https://www.google.ms/url?q=https://indianpharmacy.company india online pharmacy best india pharmacy п»їlegitimate online pharmacies india and india pharmacy mail order indian pharmacy paypal
RobertJarly
sildenafil citrate online pharmacy: rite rx care pharmacy – online pharmacy loratadine
JamesHor
reputable mexican pharmacies online: medicine in mexico pharmacies – mexican mail order pharmacies http://indianpharmacy.company/# top online pharmacy india
Mauriceirons
cipro pharmacy: mutual of omaha rx pharmacy – how to buy viagra at pharmacy
Josephgok
buying from online mexican pharmacy mexican mail order pharmacies pharmacies in mexico that ship to usa
DavidSam
pharmacy direct viagra diovan online pharmacy or Depo-Medrol https://clients1.google.com.kw/url?q=https://pharmbig24.com legit mexican pharmacy domperidone australia pharmacy clomiphene citrate online pharmacy and best pharmacy price on viagra trusted online pharmacy cialis
JamesHor
reputable indian online pharmacy: india online pharmacy – Online medicine order http://mexicopharmacy.cheap/# mexico drug stores pharmacies
HenryJaics
casibom giris adresi: casibom giris – casibom guncel giris https://casibom.auction/# casibom giris
HoustonJer
casibom guncel: casibom guncel giris – casibom giris betine sikayet betine promosyon kodu betine promosyon kodu 2024
JamesSpugh
casibom casibom giris casibom guncel
HenryJaics
gates of olympus slot: gates of olympus demo oyna – gates of olympus demo turkce oyna http://starzbet.shop/# straz bet
Georgejet
https://casibom.auction/# casibom giris
HoustonJer
starzbet giris: starzbet guncel giris – starzbet guncel giris starzbet guncel giris starzbet starz bet giris
JamesSpugh
casibom guncel giris adresi casibom guncel giris casibom 158 giris
HenryJaics
casibom guncel: casibom guncel giris adresi – casibom giris https://betine.online/# betine giris
DelbertDyete
casibom guncel giris adresi: casibom giris adresi – casibom giris https://casibom.auction/# casibom giris adresi
JamesSpugh
casibom guncel giris casibom giris casibom guncel giris adresi
HenryJaics
casibom guncel giris: casibom guncel – casibom giris https://starzbet.shop/# starzbet guncel giris
Darnellmob
gates of olympus oyna demo Gates of Olympus or gates of olympus demo oyna https://images.google.ki/url?sa=t&url=https://gatesofolympusoyna.online gates of olympus oyna demo gates of olympus turkce gates of olympus slot and gate of olympus oyna gates of olympus demo turkce oyna
DelbertDyete
casibom 158 giris: casibom giris – casibom guncel http://casibom.auction/# casibom 158 giris
JoshuaDit
casibom guncel giris casibom or casibom http://maps.google.co.zw/url?q=http://casibom.auction casibom casibom giris casibom guncel and casibom giris casibom
HenryJaics
starzbet guvenilir mi: straz bet – starzbet giris https://casibom.auction/# casibom guncel giris
Georgejet
http://starzbet.shop/# starzbet guncel giris
Georgejet
https://betine.online/# betine sikayet
HenryJaics
betine com guncel giris: betine promosyon kodu 2024 – betine com guncel giris https://gatesofolympusoyna.online/# gates of olympus demo
DelbertDyete
casibom guncel giris adresi: casibom guncel giris adresi – casibom https://casibom.auction/# casibom giris
HoustonJer
casibom guncel giris adresi: casibom 158 giris – casibom guncel gates of olympus demo oyna gates of olympus slot gates of olympus giris
Darnellmob
gate of olympus oyna gates of olympus turkce or Gates of Olympus http://intra.etinar.com/xampp/phpinfo.php?a=Viagrageneric gates of olympus demo turkce oyna gates of olympus giris gates of olympus demo turkce oyna and gates of olympus giris gates of olympus turkce
MarcusCiz
betine com guncel giris betine sikayet or betine com guncel giris https://www.google.bj/url?sa=t&url=https://betine.online betine promosyon kodu 2024 betine guncel betine promosyon kodu and betine betine promosyon kodu 2024
HenryJaics
betine promosyon kodu 2024: betine guncel – betine promosyon kodu https://betine.online/# betine com guncel giris
MarcusCiz
betine giris betine giris or betine guncel giris http://www.marcomanfredini.it/radio/visualizzacollezione.php?paginanews=5&contenuto=13&quale=40&origine=https://betine.online betine com guncel giris betine betine com guncel giris and betine betine guncel
Georgejet
http://casibom.auction/# casibom
HenryJaics
casibom guncel: casibom guncel giris – casibom guncel https://starzbet.shop/# starzbet guvenilir mi
JoshuaDit
casibom guncel giris casibom giris or casibom giris http://ditu.google.cn/url?q=http://casibom.auction casibom guncel giris casibom giris casibom guncel giris and casibom guncel giris casibom
JamesSpugh
betine promosyon kodu betine guncel betine promosyon kodu
DelbertDyete
casibom guncel giris: casibom guncel – casibom https://casibom.auction/# casibom giris adresi
HoustonJer
betine com guncel giris: betine guncel giris – betine guncel betine betine guncel betine promosyon kodu
DelbertDyete
casibom 158 giris: casibom giris adresi – casibom guncel giris adresi https://casibom.auction/# casibom giris adresi
JamesSpugh
starz bet giris starzbet guncel giris starzbet
HoustonJer
betine promosyon kodu: betine promosyon kodu – betine guncel starzbet guvenilir mi starzbet giris starzbet guncel giris
HenryJaics
starzbet: starzbet giris – starzbet giris https://casibom.auction/# casibom guncel giris
JamesSpugh
casibom giris adresi casibom giris adresi casibom giris adresi
HoustonJer
gates of olympus oyna demo: gates of olympus demo – gates of olympus giris casibom 158 giris casibom guncel giris casibom giris
Georgejet
http://starzbet.shop/# starzbet guncel giris
DelbertDyete
casibom guncel giris: casibom guncel giris – casibom guncel giris https://casibom.auction/# casibom giris adresi
JasonRow
starzbet guvenilir mi starzbet giris or starzbet guncel giris http://images.google.com.tr/url?q=https://starzbet.shop starz bet giris starzbet guvenilir mi starzbet guvenilir mi and starzbet guvenilir mi starzbet guncel giris
HoustonJer
starzbet guncel giris: starzbet guvenilir mi – straz bet starzbet guncel giris starzbet starzbet
HenryJaics
gates of olympus turkce: gates of olympus slot – gates of olympus demo http://casibom.auction/# casibom guncel
Zdsaej
purchase cyproheptadine – where can i buy tizanidine tizanidine online order
MarcusCiz
betine promosyon kodu betine guncel or betine promosyon kodu https://www.google.com.hk/url?sa=t&url=https://betine.online betine guncel betine giris betine and betine promosyon kodu 2024 betine promosyon kodu 2024
DennisPoize
https://tadalafilo.bid/# farmacia en casa online descuento
Jamesgoalp
farmacia online 24 horas: farmacia envio gratis – farmacia online envГo gratis
FloydMycle
https://tadalafilo.bid/# farmacias direct farmacia barata
FloydMycle
http://tadalafilo.bid/# farmacia online envГo gratis farmacia online espaГ±a envГo internacional
Ronaldopics
sildenafil 100mg genГ©rico Viagra sildenafilo sildenafilo 100mg precio espaГ±a
Jamesgoalp
farmacias online seguras: farmacia online 24 horas – farmacias direct
DennisPoize
https://tadalafilo.bid/# farmacia barata
Ronaldopics
farmacias online seguras comprar cialis online sin receta farmacias online seguras en espaГ±a
ShannonVaf
sildenafilo 50 mg precio sin receta farmacia gibraltar online viagra or se puede comprar sildenafil sin receta https://clients1.google.com.tr/url?q=https://sildenafilo.men viagra online cerca de malaga sildenafilo cinfa sin receta se puede comprar viagra sin receta and sildenafilo 100mg precio espaГ±a comprar viagra en espaГ±a envio urgente contrareembolso
Jamesgoalp
viagra online cerca de bilbao: viagra precio – viagra precio 2022
DennisPoize
https://farmaciaeu.com/# farmacia online barcelona
RichardJep
farmacias direct farmacia online madrid or farmacia online 24 horas https://images.google.ws/url?sa=t&url=https://tadalafilo.bid farmacia online barcelona farmacia online envГo gratis farmacias online seguras and farmacia barata farmacias online seguras
NormanBow
sildenafilo precio farmacia: viagra precio – viagra online rГЎpida
DennisPoize
https://sildenafilo.men/# se puede comprar sildenafil sin receta
ThomasJox
farmacia online espaГ±a envГo internacional farmacia online envГo gratis or farmacias online seguras en espaГ±a https://www.google.am/url?q=https://farmaciaeu.com farmacias online baratas farmacias online seguras farmacia online barcelona and farmacia online madrid farmacia en casa online descuento
Jamesgoalp
farmacia online barata: farmacia online internacional – farmacia online envГo gratis
Ronaldopics
viagra online cerca de zaragoza viagra precio comprar viagra sin gastos de envГo
FloydMycle
http://tadalafilo.bid/# farmacia online envГo gratis farmacias online seguras
FloydMycle
http://farmaciaeu.com/# farmacias online seguras en espaГ±a farmacia en casa online descuento
DennisPoize
http://farmaciaeu.com/# farmacia online envГo gratis
Jamesgoalp
farmacias online seguras en espaГ±a: farmacia online envio gratis valencia – farmacia online espaГ±a envГo internacional
GlennUnfow
farmacia online envГo gratis farmacia online barata y fiable or farmacias online seguras https://www.google.com.kh/url?q=https://farmaciaeu.com farmacias online seguras en espaГ±a farmacia barata п»їfarmacia online espaГ±a and farmacia online espaГ±a envГo internacional farmacias online seguras en espaГ±a
DennisPoize
https://tadalafilo.bid/# farmacia online barata y fiable
GlennUnfow
farmacias online seguras farmacia barata or farmacia online barata http://aanorthflorida.org/es/redirect.asp?url=http://farmaciaeu.com farmacias online seguras en espaГ±a farmacia barata farmacia online espaГ±a envГo internacional and farmacia online madrid farmacia online barcelona
DennisPoize
https://farmaciaeu.com/# farmacia online barcelona
Jamesgoalp
farmacias online baratas: precio cialis en farmacia con receta – farmacias online seguras en espaГ±a
RichardJep
farmacias online seguras farmacia barata or п»їfarmacia online espaГ±a https://www.google.com.ar/url?q=https://tadalafilo.bid farmacias online seguras farmacia online envГo gratis farmacias online seguras and farmacias online seguras en espaГ±a farmacia barata
RichardJep
farmacias online baratas farmacias online seguras en espaГ±a or farmacias online baratas https://maps.google.be/url?q=https://tadalafilo.bid farmacia online envГo gratis farmacia online madrid farmacia online envГo gratis and farmacia online 24 horas farmacias online seguras en espaГ±a
FloydMycle
https://sildenafilo.men/# sildenafilo 100mg precio espaГ±a farmacia online madrid
FloydMycle
http://farmaciaeu.com/# farmacia online envГo gratis farmacias online seguras en espaГ±a
Jamesgoalp
farmacias online baratas: comprar tadalafilo – farmacia online barata
DennisPoize
http://tadalafilo.bid/# farmacias online seguras
Jamesgoalp
farmacias online seguras en espaГ±a: Cialis sin receta – п»їfarmacia online espaГ±a
DennisPoize
https://sildenafilo.men/# viagra precio 2022
Ysuqct
buy artane pills – purchase voltaren gel sale how to purchase voltaren gel
Jamesgoalp
farmacia online 24 horas: cialis 20 mg precio farmacia – farmacia online barcelona
ThomasJox
farmacia online envГo gratis farmacia online envГo gratis or farmacia online 24 horas http://www.dot-blank.com/feed2js/feed2js.php?src=https://farmaciaeu.com:: farmacias direct farmacias online seguras п»їfarmacia online espaГ±a and farmacia online 24 horas farmacia en casa online descuento
CharlesGrart
Farmacia online piГ№ conveniente Cialis generico 5 mg prezzo farmacia online
EdwardUnorn
migliori farmacie online 2024 Cialis generico controindicazioni Farmacie on line spedizione gratuita
Charlesnum
http://tadalafilit.com/# farmacie online sicure comprare farmaci online con ricetta
Charlesnum
https://farmaciait.men/# farmacie online affidabili farmacie online autorizzate elenco
EdisonAveft
farmacia online senza ricetta: Cialis generico farmacia – farmacia online senza ricetta
CharlesGrart
farmacie online autorizzate elenco Farmacie online sicure farmaci senza ricetta elenco
EdwardUnorn
le migliori pillole per lerezione viagra online siti sicuri dove acquistare viagra in modo sicuro
LouisSpugs
cialis farmacia senza ricetta: viagra senza ricetta – viagra generico recensioni
EdisonAveft
farmacia online senza ricetta: Farmacie online sicure – migliori farmacie online 2024
CharlesGrart
acquistare farmaci senza ricetta Cialis generico prezzo Farmacia online piГ№ conveniente
Charlesnum
https://farmaciait.men/# comprare farmaci online con ricetta Farmacie online sicure
Charlesnum
https://tadalafilit.com/# farmacie online autorizzate elenco acquistare farmaci senza ricetta
CharlesGrart
acquistare farmaci senza ricetta Cialis generico prezzo farmacia online piГ№ conveniente
EdisonAveft
migliori farmacie online 2024: Tadalafil generico migliore – Farmacia online miglior prezzo
LouisSpugs
comprare farmaci online allestero: Cialis generico farmacia – farmacia online piГ№ conveniente
CharlesGrart
Farmacia online miglior prezzo Cialis generico 20 mg 8 compresse prezzo acquistare farmaci senza ricetta
KennethOvall
viagra originale recensioni siti sicuri per comprare viagra online or viagra originale in 24 ore contrassegno http://www.pandct.com/link.asp?webaddress=sildenafilit.pro viagra originale in 24 ore contrassegno esiste il viagra generico in farmacia viagra generico sandoz and viagra subito viagra subito
EdwardUnorn
farmacie online sicure Cialis generico prezzo Farmacie on line spedizione gratuita
LouisSpugs
kamagra senza ricetta in farmacia: viagra senza ricetta – viagra consegna in 24 ore pagamento alla consegna
EdisonAveft
migliori farmacie online 2024: Cialis generico farmacia – acquistare farmaci senza ricetta
CharlesGrart
Farmacia online miglior prezzo Cialis generico farmacia farmacia online piГ№ conveniente
KennethRiz
https://brufen.pro/# Brufen 600 prezzo acquisto farmaci con ricetta
KennethRiz
https://farmaciait.men/# comprare farmaci online con ricetta п»їFarmacia online migliore
EdgardeT
Farmacia online miglior prezzo: Farmacia online piu conveniente – acquisto farmaci con ricetta
PatrickNeide
comprare farmaci online allestero: Ibuprofene 600 prezzo senza ricetta – farmacie online sicure
Michaelbup
viagra acquisto in contrassegno in italia viagra viagra pfizer 25mg prezzo
EdgardeT
viagra generico in farmacia costo: viagra farmacia – viagra naturale
Robertdoott
Farmacie online sicure top farmacia online or Farmacia online piГ№ conveniente https://www.google.com.jm/url?q=https://tadalafilit.com acquistare farmaci senza ricetta farmacie online affidabili acquisto farmaci con ricetta and comprare farmaci online con ricetta farmaci senza ricetta elenco
Richarddob
farmacia online senza ricetta BRUFEN 600 bustine prezzo acquisto farmaci con ricetta
KennethMib
farmacia online farmacie online sicure or п»їFarmacia online migliore https://www.rolleriklubi.net/proxy.php?link=https://farmaciait.men Farmacia online piГ№ conveniente migliori farmacie online 2024 migliori farmacie online 2024 and Farmacie online sicure farmacia online piГ№ conveniente
Richarddob
viagra generico recensioni viagra online siti sicuri miglior sito dove acquistare viagra
KennethRiz
http://tadalafilit.com/# Farmacie on line spedizione gratuita comprare farmaci online allestero
KennethOvall
viagra naturale in farmacia senza ricetta viagra generico sandoz or viagra naturale https://images.google.com.ag/url?sa=t&url=https://sildenafilit.pro viagra originale in 24 ore contrassegno siti sicuri per comprare viagra online dove acquistare viagra in modo sicuro and viagra naturale pillole per erezione in farmacia senza ricetta
KennethOvall
pillole per erezione in farmacia senza ricetta dove acquistare viagra in modo sicuro or kamagra senza ricetta in farmacia https://maps.google.cl/url?sa=t&url=https://sildenafilit.pro alternativa al viagra senza ricetta in farmacia cerco viagra a buon prezzo gel per erezione in farmacia and gel per erezione in farmacia cerco viagra a buon prezzo
EdgardeT
farmacie online sicure: Cialis generico recensioni – migliori farmacie online 2024
Richarddob
comprare farmaci online con ricetta BRUFEN 600 prezzo in farmacia farmacia online piГ№ conveniente
Richarddob
viagra consegna in 24 ore pagamento alla consegna viagra online siti sicuri viagra originale in 24 ore contrassegno
EdgardeT
Farmacie online sicure: Farmacie online sicure – acquisto farmaci con ricetta
EdgardeT
farmacie online autorizzate elenco: Ibuprofene 600 generico prezzo – comprare farmaci online allestero
KennethRiz
http://tadalafilit.com/# farmacie online affidabili farmacia online piГ№ conveniente
KennethRiz
http://brufen.pro/# Brufen 600 prezzo Farmacia online miglior prezzo
Michaelbup
farmacie online autorizzate elenco Cialis generico prezzo acquisto farmaci con ricetta
Robertdoott
Farmacia online miglior prezzo farmacia online or farmacia online https://images.google.com.br/url?sa=t&url=https://tadalafilit.com farmaci senza ricetta elenco Farmacie online sicure Farmacie online sicure and Farmacia online piГ№ conveniente acquisto farmaci con ricetta
Richarddob
farmacia online piГ№ conveniente Ibuprofene 600 prezzo senza ricetta farmacia online piГ№ conveniente
EdgardeT
migliori farmacie online 2024: Farmacia online migliore – farmacie online autorizzate elenco
Richarddob
dove acquistare viagra in modo sicuro viagra online siti sicuri pillole per erezioni fortissime
PatrickNeide
farmacia online piГ№ conveniente: Farmacia online piu conveniente – farmaci senza ricetta elenco
EdgardeT
Farmacia online miglior prezzo: Farmacie che vendono Cialis senza ricetta – acquisto farmaci con ricetta
Michaelbup
comprare farmaci online con ricetta Farmacia online migliore Farmacie online sicure
KennethRiz
https://tadalafilit.com/# migliori farmacie online 2024 farmacia online
KennethMib
farmacia online piГ№ conveniente farmacia online senza ricetta or comprare farmaci online allestero http://nou-rau.uem.br/nou-rau/zeus/auth.php?back=http://farmaciait.men&go=x&code=x&unit=x Farmacie online sicure migliori farmacie online 2024 farmacie online affidabili and Farmacia online miglior prezzo п»їFarmacia online migliore
KennethOvall
viagra ordine telefonico gel per erezione in farmacia or esiste il viagra generico in farmacia http://anonym.es/?https://sildenafilit.pro/ viagra generico recensioni viagra prezzo farmacia 2023 cerco viagra a buon prezzo and viagra online in 2 giorni viagra naturale in farmacia senza ricetta
KennethOvall
viagra online spedizione gratuita viagra cosa serve or pillole per erezione in farmacia senza ricetta https://maps.google.bs/url?q=http://sildenafilit.pro cialis farmacia senza ricetta cialis farmacia senza ricetta pillole per erezione in farmacia senza ricetta and alternativa al viagra senza ricetta in farmacia dove acquistare viagra in modo sicuro
EdgardeT
viagra pfizer 25mg prezzo: viagra generico – kamagra senza ricetta in farmacia
Michaelbup
viagra prezzo farmacia 2023 viagra esiste il viagra generico in farmacia
Richarddob
farmacie online sicure Farmacia online migliore acquistare farmaci senza ricetta
EdgardeT
migliori farmacie online 2024: Farmacie online sicure – Farmacie on line spedizione gratuita
Michaelbup
farmaci senza ricetta elenco Brufen 600 prezzo con ricetta farmacia online piГ№ conveniente
PatrickNeide
farmacia online piГ№ conveniente: Farmacia online migliore – п»їFarmacia online migliore
Robertdoott
farmacie online sicure п»їFarmacia online migliore or farmacia online http://www.jachta.lt/mecstats/index.php?page=reffer_detail&dom=tadalafilit.com comprare farmaci online allestero top farmacia online Farmacia online piГ№ conveniente and comprare farmaci online allestero farmacie online affidabili
Richarddob
п»їFarmacia online migliore Brufen 600 senza ricetta farmaci senza ricetta elenco
KennethRiz
https://brufen.pro/# Ibuprofene 600 prezzo senza ricetta Farmacia online piГ№ conveniente
Robertdoott
farmacie online autorizzate elenco comprare farmaci online allestero or migliori farmacie online 2024 http://www.google.ac/url?q=http://tadalafilit.com comprare farmaci online allestero Farmacia online piГ№ conveniente top farmacia online and migliori farmacie online 2024 Farmacie on line spedizione gratuita
Qvisda
buy cefdinir 300mg – order cefdinir 300mg sale buy clindamycin gel
EdgardeT
Farmacia online miglior prezzo: Farmacie online sicure – comprare farmaci online con ricetta
Richarddob
viagra online consegna rapida viagra senza ricetta viagra prezzo farmacia 2023
KennethMib
comprare farmaci online con ricetta migliori farmacie online 2024 or Farmacia online miglior prezzo https://www.smartspace.ws/login.php?TraderId=1123&rdurl=https://farmaciait.men::: farmacia online piГ№ conveniente farmacie online sicure acquistare farmaci senza ricetta and acquisto farmaci con ricetta Farmacie on line spedizione gratuita
EdgardeT
top farmacia online: farmacia online migliore – п»їFarmacia online migliore
Michaelbup
viagra originale in 24 ore contrassegno acquisto viagra viagra originale in 24 ore contrassegno
Richarddob
acquisto farmaci con ricetta Farmacie online sicure acquisto farmaci con ricetta
JosephFew
cheap Rybelsus 14 mg: rybelsus cost – rybelsus price
Davidchida
neurontin 300 mg mexico: order neurontin – discount neurontin
AlfredAbess
Rybelsus 7mg semaglutide cheap Rybelsus 14 mg
SergioKat
https://prednisolone.pro/# can i purchase prednisone without a prescription
SergioKat
https://furosemide.men/# lasix 100 mg tablet
Arnoldomits
neurontin from canada: neurontin 500 mg tablet – neurontin for sale online
JosephFew
ventolin brand: Buy Ventolin inhaler online – ventolin hfa 90 mcg
AlfredAbess
Rybelsus 7mg rybelsus price cheap Rybelsus 14 mg
Davidchida
lasix 40mg: lasix – lasix 100mg
Michaeltepay
rybelsus generic rybelsus price or Buy semaglutide pills http://www.stuff4beauty.com/outlet/popup-window.php?url=rybelsus.tech Buy semaglutide pills Buy semaglutide pills Rybelsus 7mg and Buy compounded semaglutide online rybelsus cost
Jamesaxome
prednisone pill prices prednisone 475 or prednisone 20 mg pill http://maps.google.gm/url?q=https://prednisolone.pro prednisone 2.5 mg tab prednisone tablets 2.5 mg prednisone 10 mg tablet and buy prednisone 5mg canada over the counter prednisone cheap
SergioKat
http://rybelsus.tech/# buy rybelsus
SergioKat
http://rybelsus.tech/# Rybelsus 7mg
JosephFew
lasix: buy furosemide – lasix furosemide 40 mg
AlfredAbess
prednisone 10mg cost prednisone prednisone canada
Horacealott
generic neurontin cost buy brand neurontin or neurontin medicine http://clients1.google.mk/url?q=https://gabapentin.site purchase neurontin online neurontin cost in canada neurontin pills for sale and neurontin 300 mg cap neurontin cap 300mg price
JosephFew
lasix medication: buy furosemide – buy lasix online
Dwightshida
ventolin 108 ventolin capsule or ventolin order online without prescription http://sexynews24.com/exlink.php?url=http://ventolininhaler.pro/ generic ventolin can i buy ventolin over the counter in usa ventolin brand and buy ventolin online australia buy ventolin online cheap
Davidchida
buy ventolin in mexico: buy albuterol inhaler – ventolin tablet
Josephnub
prednisone: prednisone brand name india – prednisone 10mg for sale
Josephnub
lasix side effects: buy furosemide – lasix 100mg
Zdjupv
order isotretinoin 40mg for sale – avlosulfon canada order deltasone 5mg online
Michaeltepay
Buy compounded semaglutide online rybelsus price or buy rybelsus http://alt1.toolbarqueries.google.gy/url?q=https://rybelsus.tech rybelsus generic Buy semaglutide pills semaglutide and Buy semaglutide pills Semaglutide pharmacy price
SergioKat
http://gabapentin.site/# neurontin 600 mg tablet
SergioKat
http://furosemide.men/# lasix pills
Davidchida
prednisone 20mg by mail order: prednisone 40 mg daily – prednisone cost in india
Josephnub
furosemide 100 mg: cheap lasix – lasix uses
Josephnub
ventolin evohaler: Ventolin inhaler price – ventolin pharmacy uk
Jamesaxome
prednisone daily prednisone canada prices or where to buy prednisone in australia http://lonevelde.lovasok.hu/out_link.php?url=https://prednisolone.pro buying prednisone on line prednisone cost us 40 mg daily prednisone and prednisone brand name india prednisone 5 mg tablet without a prescription
Davidchida
lasix generic: cheap lasix – furosemide 100mg
JosephFew
prednisone 10mg cost: prednisone 20mg online without prescription – prednisone uk price
Horacealott
how to get neurontin cheap cost of neurontin 800 mg or brand name neurontin http://sermedin.com/galeria/main.php?g2_view=core.UserAdmin&g2_subView=core.UserLogin&g2_return=https://gabapentin.site/ brand name neurontin neurontin tablets 300 mg neurontin 1200 mg and where to buy neurontin neurontin prices generic
JosephFew
ventolin tablets buy: buy albuterol inhaler – ventolin 2mg
Davidchida
generic prednisone pills: buy prednisone from india – prednisone 10 mg daily
SergioKat
https://ventolininhaler.pro/# buy ventolin online uk
SergioKat
http://rybelsus.tech/# Buy semaglutide pills
Dwightshida
order ventolin online no prescription ventolin usa over the counter or ventolin 95mcg https://images.google.lu/url?q=https://ventolininhaler.pro ventolin prices ventolin sale uk can i buy ventolin over the counter uk and ventolin otc ventolin otc canada
JosephFew
lasix 40mg: buy furosemide – furosemide
Josephnub
Rybelsus 7mg: Buy semaglutide pills – cheap Rybelsus 14 mg
Michaeltepay
rybelsus buy rybelsus or Buy compounded semaglutide online https://www.fd-zert.de/fpdeu/inc/mitglieder_form.asp?nr=27&referer=https://rybelsus.tech rybelsus cost Rybelsus 7mg semaglutide and cheap Rybelsus 14 mg buy rybelsus
Dwightshida
where to get ventolin cheap ventolin 200 mg or how much is a ventolin http://101.43.178.182/sell/email.asp?d=ventolininhaler.pro&on=tb where can i buy ventolin in uk ventolin uk price online ventolin and ventolin online pharmacy ventolin 4mg
Davidchida
semaglutide: Buy compounded semaglutide online – Buy compounded semaglutide online
RogerAdolf
canadian online drugstore: Canadian Pharmacy – safe online pharmacies in canada
Robertsanda
buying prescription drugs in mexico mexican drugstore online purple pharmacy mexico price list
Robertsanda
indian pharmacy paypal Indian pharmacy international shipping india online pharmacy
TimothySab
canadian pharmacy scam: Online medication home delivery – canadian pharmacy no scripts
RogerAdolf
purple pharmacy mexico price list: mexican border pharmacies shipping to usa – pharmacies in mexico that ship to usa
Daviddaf
mexico drug stores pharmacies mexican drugstore online or medicine in mexico pharmacies https://maps.google.ne/url?q=https://mexicanpharma.icu medicine in mexico pharmacies mexican pharmaceuticals online buying from online mexican pharmacy and mexican rx online mexico pharmacies prescription drugs
TimothySab
india pharmacy: Indian pharmacy online – Online medicine order
Ronaldsmirm
mexican pharmaceuticals online mexican mail order pharmacies or mexico drug stores pharmacies https://cse.google.co.th/url?q=https://mexicanpharma.icu buying prescription drugs in mexico mexican online pharmacies prescription drugs mexican pharmaceuticals online and purple pharmacy mexico price list buying prescription drugs in mexico
RogerAdolf
Online medicine order: Online medication home delivery – Online medicine home delivery
RogerAdolf
global pharmacy canada: Pharmacies in Canada that ship to the US – canadian pharmacies comparison
Jameslooxy
https://canadapharma.shop/# canadian pharmacy reviews
Robertsanda
legal canadian pharmacy online canadian pharmacies compare canadian pharmacy meds review
Robertsanda
mexico drug stores pharmacies mexico pharmacies prescription drugs medicine in mexico pharmacies
RogerAdolf
buying from online mexican pharmacy: buying from online mexican pharmacy – purple pharmacy mexico price list
Daviddaf
buying prescription drugs in mexico online buying from online mexican pharmacy or mexican pharmaceuticals online http://cse.google.co.vi/url?q=https://mexicanpharma.icu mexico pharmacies prescription drugs mexico drug stores pharmacies mexico drug stores pharmacies and buying prescription drugs in mexico online mexican pharmaceuticals online
RichardHap
india online pharmacy best online pharmacy india or online pharmacy india https://www.google.pn/url?q=https://indiadrugs.pro top 10 online pharmacy in india reputable indian pharmacies india online pharmacy and indianpharmacy com reputable indian pharmacies
TimothySab
india online pharmacy: Indian pharmacy international shipping – reputable indian pharmacies
RichardHap
online pharmacy india india pharmacy or best online pharmacy india http://kinderundjugendpsychotherapie.de/url?q=https://indiadrugs.pro reputable indian pharmacies п»їlegitimate online pharmacies india Online medicine order and Online medicine home delivery reputable indian pharmacies
Jameslooxy
https://canadapharma.shop/# canadianpharmacymeds
Jameslooxy
http://canadapharma.shop/# cheap canadian pharmacy online
Daviddaf
mexico drug stores pharmacies purple pharmacy mexico price list or best online pharmacies in mexico https://clients1.google.dm/url?q=https://mexicanpharma.icu mexico pharmacies prescription drugs pharmacies in mexico that ship to usa medication from mexico pharmacy and best online pharmacies in mexico mexico pharmacies prescription drugs
Ronaldsmirm
reputable mexican pharmacies online purple pharmacy mexico price list or medication from mexico pharmacy https://maps.google.sh/url?q=https://mexicanpharma.icu mexico pharmacies prescription drugs medicine in mexico pharmacies mexico drug stores pharmacies and buying from online mexican pharmacy buying prescription drugs in mexico
RogerAdolf
mexican rx online: mexican border pharmacies shipping to usa – pharmacies in mexico that ship to usa
DavidKak
buying prescription drugs in mexico https://mexicanpharma.icu/# medication from mexico pharmacy mexico drug stores pharmacies
Robertsanda
best india pharmacy cheapest online pharmacy india indian pharmacy
Robertsanda
Online medicine order Indian pharmacy online india pharmacy
Jameslooxy
https://mexicanpharma.icu/# mexico drug stores pharmacies
RogerAdolf
buy prescription drugs from india: indian pharmacy – best india pharmacy
Jameslooxy
http://indiadrugs.pro/# Online medicine home delivery
DavidKak
mexico pharmacies prescription drugs http://mexicanpharma.icu/# mexico drug stores pharmacies buying from online mexican pharmacy
Jameslooxy
http://indiadrugs.pro/# buy prescription drugs from india
Robertsanda
safe online pharmacies in canada pharmacy wholesalers canada canadian family pharmacy
Jameslooxy
https://canadapharma.shop/# best online canadian pharmacy
RichardHap
online shopping pharmacy india best india pharmacy or indian pharmacy online https://apps2.poligran.edu.co/elearnpubl/bannergo.aspx?R=https://indiadrugs.pro top online pharmacy india online pharmacy india mail order pharmacy india and buy prescription drugs from india best online pharmacy india
Daviddaf
medicine in mexico pharmacies mexican drugstore online or best online pharmacies in mexico http://images.google.la/url?q=https://mexicanpharma.icu mexico drug stores pharmacies п»їbest mexican online pharmacies buying from online mexican pharmacy and buying from online mexican pharmacy buying from online mexican pharmacy
Ronaldsmirm
mexican border pharmacies shipping to usa mexican border pharmacies shipping to usa or buying from online mexican pharmacy http://www.halifaxforum.ca/redirect.aspx?destination=http://mexicanpharma.icu mexican online pharmacies prescription drugs medicine in mexico pharmacies п»їbest mexican online pharmacies and mexican pharmaceuticals online mexican pharmaceuticals online
Jameslooxy
https://indiadrugs.pro/# mail order pharmacy india
Moderné kuchyne na mieru
Hello there, I found your web site by way of Google while looking for a similar subject, your site got here up, it looks great. I’ve bookmarked it in my google bookmarks.
Robertsanda
reliable canadian pharmacy reviews real canadian pharmacy drugs from canada
Robertsanda
canada drugs online review real canadian pharmacy legitimate canadian pharmacy
JamesBeeks
mexico pharmacies prescription drugs: mexican mail order pharmacies – mexican drugstore online mexican pharmaceuticals online
Pptigi
prednisone 40mg uk – purchase permethrin for sale buy generic permethrin for sale
Jameslooxy
https://indiadrugs.pro/# reputable indian online pharmacy
kuchyne na mieru
Good write-up, I’m regular visitor of one’s web site, maintain up the nice operate, and It’s going to be a regular visitor for a long time.
HeathCox
pharmacie en ligne france pas cher: pharmacie en ligne sans ordonnance – trouver un mГ©dicament en pharmacie
JamesBeeks
mexican border pharmacies shipping to usa: buying prescription drugs in mexico – mexico drug stores pharmacies buying prescription drugs in mexico
HeathCox
Viagra sans ordonnance pharmacie France: Viagra prix – Meilleur Viagra sans ordonnance 24h
Stephengit
http://vgrsansordonnance.com/# Viagra homme sans prescription
Charlesfoowl
Pharmacie sans ordonnance pharmacie en ligne pas cher pharmacie en ligne
Charlesfoowl
Prix du Viagra en pharmacie en France Viagra sans ordonnance 24h Prix du Viagra 100mg en France
HeathCox
SildГ©nafil 100mg pharmacie en ligne: Acheter du Viagra sans ordonnance – Viagra Pfizer sans ordonnance
HeathCox
Pharmacie sans ordonnance: Medicaments en ligne livres en 24h – pharmacies en ligne certifiГ©es
Davidcyday
п»їpharmacie en ligne france pharmacie en ligne sans ordonnance or Achat mГ©dicament en ligne fiable http://webservices.icodes.co.uk/transfer2.php?location=https://pharmaciepascher.pro pharmacie en ligne sans ordonnance Pharmacie sans ordonnance п»їpharmacie en ligne france and pharmacie en ligne pas cher pharmacie en ligne france livraison belgique
HeathCox
Viagra prix pharmacie paris: Acheter du Viagra sans ordonnance – Viagra homme sans prescription
Stephenlausy
Viagra 100 mg sans ordonnance Viagra gГ©nГ©rique sans ordonnance en pharmacie or Viagra homme sans ordonnance belgique https://secure.spicecash.com/hosted_sssh_galleries/3/index.html?link=https://vgrsansordonnance.com SildГ©nafil 100 mg prix en pharmacie en France SildГ©nafil Teva 100 mg acheter Viagra femme sans ordonnance 24h and Viagra sans ordonnance 24h suisse Viagra homme prix en pharmacie sans ordonnance
HeathCox
pharmacie en ligne france pas cher: Cialis generique achat en ligne – pharmacie en ligne france livraison internationale
Charlesfoowl
pharmacie en ligne france livraison belgique pharmacie en ligne pas cher vente de mГ©dicament en ligne
Charlesfoowl
pharmacie en ligne france livraison belgique Pharmacies en ligne certifiees pharmacie en ligne fiable
Donaldfet
purple pharmacy mexico price list: mexican pharmacy – buying prescription drugs in mexico mexico drug stores pharmacies
HeathCox
pharmacie en ligne: Pharmacies en ligne certifiees – pharmacie en ligne sans ordonnance
Stephengit
https://vgrsansordonnance.com/# Viagra vente libre allemagne
HeathCox
п»їpharmacie en ligne france: Cialis generique achat en ligne – pharmacie en ligne livraison europe
HeathCox
Pharmacie sans ordonnance: cialis sans ordonnance – Pharmacie Internationale en ligne
Charlesfoowl
Viagra pas cher livraison rapide france Viagra prix Viagra gГ©nГ©rique sans ordonnance en pharmacie
Charlesfoowl
pharmacie en ligne Cialis sans ordonnance pas cher acheter mГ©dicament en ligne sans ordonnance
rybelsusBoofs
rybelsus cost http://rybelsus.tech/# rybelsus cost semaglutide
Davidcyday
pharmacies en ligne certifiГ©es acheter mГ©dicament en ligne sans ordonnance or vente de mГ©dicament en ligne https://cse.google.co.ao/url?q=https://pharmaciepascher.pro п»їpharmacie en ligne france Pharmacie sans ordonnance pharmacie en ligne france pas cher and Pharmacie Internationale en ligne Pharmacie Internationale en ligne
HeathCox
Viagra homme prix en pharmacie sans ordonnance: Sildenafil Viagra – Viagra Pfizer sans ordonnance
Stephenlausy
Viagra sans ordonnance 24h suisse Viagra sans ordonnance 24h suisse or Viagra femme ou trouver https://cse.google.ms/url?sa=t&url=https://vgrsansordonnance.com Viagra homme prix en pharmacie sans ordonnance Viagra pas cher livraison rapide france Viagra homme prix en pharmacie sans ordonnance and Viagra prix pharmacie paris Viagra homme prix en pharmacie sans ordonnance
louisiana registered agent search,louisiana registered agent service,louisiana registered agent services
I am not sure where you’re getting your information, but good topic. I needs to spend some time learning much more or understanding more. Thanks for magnificent information I was looking for this information for my mission.
HeathCox
Viagra vente libre pays: viagra en ligne – Viagra sans ordonnance 24h suisse
Charlesfoowl
п»їpharmacie en ligne france Medicaments en ligne livres en 24h pharmacie en ligne france livraison belgique
HeathCox
pharmacies en ligne certifiГ©es: Cialis generique achat en ligne – Achat mГ©dicament en ligne fiable
Stephengit
https://pharmaciepascher.pro/# pharmacie en ligne avec ordonnance
Terryjed
pharmacie en ligne france fiable acheter mГ©dicament en ligne sans ordonnance or pharmacie en ligne avec ordonnance https://www.google.co.zm/url?q=https://clssansordonnance.icu vente de mГ©dicament en ligne pharmacie en ligne france livraison belgique vente de mГ©dicament en ligne and acheter mГ©dicament en ligne sans ordonnance pharmacie en ligne france pas cher
3 day desert trip from fes
Thank you for some other magnificent article. Where else could anyone get that type of information in such a perfect method of writing? I have a presentation next week, and I am at the look for such info.
fes to marrakech desert tours
Enjoyed examining this, very good stuff, regards. “It requires more courage to suffer than to die.” by Napoleon Bonaparte.
HaroldHiz
ozempic coupon: buy ozempic pills online – ozempic generic
Frankmer
http://rybelsus.shop/# rybelsus pill
BarrySnurn
http://ozempic.art/# buy ozempic pills online
RamonVew
rybelsus cost: rybelsus price – rybelsus pill
JeremyBag
buy semaglutide pills buy semaglutide pills semaglutide online
HaroldHiz
ozempic generic: Ozempic without insurance – ozempic coupon
BarrySnurn
https://ozempic.art/# buy ozempic
Frankmer
https://rybelsus.shop/# rybelsus coupon
RamonVew
buy ozempic pills online: ozempic generic – Ozempic without insurance
HaroldHiz
buy ozempic pills online: buy cheap ozempic – buy ozempic
HaroldHiz
ozempic online: ozempic generic – Ozempic without insurance
JeremyBag
buy ozempic Ozempic without insurance ozempic
HaroldHiz
Ozempic without insurance: ozempic cost – buy ozempic
RamonVew
ozempic cost: ozempic cost – ozempic
WilburSkamy
ozempic cost Ozempic without insurance or ozempic online https://www.google.com.np/url?q=https://ozempic.art buy ozempic pills online ozempic ozempic cost and buy cheap ozempic buy ozempic pills online
JeremyBag
ozempic online Ozempic without insurance Ozempic without insurance
JamesDax
ozempic coupon ozempic online or ozempic coupon https://maps.google.sm/url?q=http://ozempic.art ozempic generic ozempic cost buy ozempic and ozempic generic buy ozempic pills online
HaroldHiz
ozempic online: ozempic coupon – ozempic cost
Frankmer
https://rybelsus.shop/# rybelsus price
BarrySnurn
http://rybelsus.shop/# rybelsus price
RamonVew
ozempic cost: Ozempic without insurance – ozempic generic
JeremyBag
semaglutide cost rybelsus cost buy semaglutide pills
HaroldHiz
Ozempic without insurance: buy cheap ozempic – ozempic generic
Frankmer
https://ozempic.art/# ozempic online
BarrySnurn
http://ozempic.art/# ozempic
HaroldHiz
rybelsus pill: semaglutide online – rybelsus pill
JamesDax
ozempic online buy cheap ozempic or Ozempic without insurance http://www.google.com.qa/url?q=https://ozempic.art ozempic ozempic buy cheap ozempic and ozempic generic ozempic coupon
JamesSmeam
rybelsus price buy semaglutide online or rybelsus coupon https://maps.google.com.my/url?q=https://rybelsus.shop buy semaglutide pills semaglutide tablets semaglutide online and cheapest rybelsus pills rybelsus cost
BarrySnurn
https://ozempic.art/# ozempic generic
JeremyBag
ozempic online ozempic cost ozempic generic
BarrySnurn
http://ozempic.art/# buy cheap ozempic
RamonVew
ozempic: buy cheap ozempic – ozempic
Mdztar
order betamethasone 20 gm generic – order monobenzone sale buy benoquin without prescription
WilburSkamy
ozempic coupon ozempic cost or buy ozempic pills online https://image.google.tt/url?q=https://ozempic.art ozempic cost Ozempic without insurance ozempic online and Ozempic without insurance buy ozempic
BarrySnurn
https://ozempic.art/# buy ozempic
JeremyBag
buy ozempic pills online ozempic buy ozempic
Obvlmi
buy metronidazole 200mg online cheap – cenforce where to buy cenforce 50mg ca
BarrySnurn
http://rybelsus.shop/# semaglutide tablets
SantoCog
http://pinupru.site/# пин ап официальный сайт
DonaldNeize
пин ап кз: pin up казино – пинап кз
DonaldNeize
pin up azerbaijan: pin-up kazino – pin up az
Forrestbub
pin up казино: пин ап казино зеркало – pin up зеркало
RobertPog
pin up bet pin up bet pin-up casino
DonaldNeize
pin-up casino giris: pin up – pinup azerbaycan
GabrielRot
пин ап кз http://pinupkz.tech/# пин ап казино онлайн пин ап казахстан
Ramiromig
пин ап казино пин ап зеркало or пин ап официальный сайт https://cse.google.co.zw/url?q=https://pinupru.site пин ап казино вход пин ап казино зеркало пин ап казино and пин ап зеркало pin up зеркало
Forrestbub
пин ап казино вход: пин ап казино – pin up казино
RobertPog
pin up giris pin-up casino pin up
DonaldNeize
pin up: pin up – pin-up oyunu
SantoCog
https://pinupkz.tech/# пинап казино
GabrielRot
пин ап казахстан http://pinupaz.bid/# pin-up oyunu пин ап кз
Forrestbub
pin-up bonanza: pin-up bonanza – pin-up bonanza
RobertPog
pin up casino pin-up bonanza pin up
GabrielRot
пин ап казино http://pinupru.site/# pin up пин ап кз
DavidheagS
pin up 306 pin up or pin up azerbaijan https://cse.google.cm/url?sa=t&url=https://pinupaz.bid pin up pinup az pinup azerbaycan and pin up azerbaijan pin up azerbaijan
SantoCog
https://pinupturkey.pro/# pin-up casino giris
MarioMaicy
pin up giris pin up bet or pin up bet https://clients1.google.com.ag/url?q=https://pinupturkey.pro pin-up casino giris pin up pin up aviator and pin up guncel giris pin up casino giris
Ramiromig
pin up пин ап зеркало or пин ап зеркало http://jm.57883.net/alexa/jm/index.asp?domain=pinupru.site пинап казино пин ап зеркало pin up казино and пин ап официальный сайт пин ап казино зеркало
GabrielRot
пин ап казино вход https://pinupaz.bid/# pin up azerbaijan пин ап казино вход
RobertPog
pin up casino pin-up casino giris pinup azerbaycan
SantoCog
http://pinupturkey.pro/# pin-up bonanza
Forrestbub
pin up: pin up – pin up 306
MarioMaicy
pin-up bonanza pin up aviator or pin up casino guncel giris https://www.google.com.pa/url?q=https://pinupturkey.pro pin up pin-up casino pin-up bonanza and pin up bet pin up aviator
GabrielRot
пинап кз https://pinupru.site/# пин ап официальный сайт pin up kz
DavidheagS
pin up az pin-up kazino or pin up az http://katiefreudenschuss.com/termin.php?veranstaltung=freudenschussplus&tag=mo&datum=19.12&zeit=203A00&location=hamburg&stadt=schmidttheater&info=freudenschussplus…0D0A0D0A…istwieeingelungenerabendmitgutenfreunden.ehrlich2CspontanundvollerDCberraschungen.0D0Akatiefreudenschuss2CsE4ngerin2Cmusikerinundsachensagerinaushamburg2Cliebtesgastgeberinzusein.inihrerbrandneuenshowlE4dtsienunkFCnstlerundkFCnstlerinnenaufihrsofaunddieshowbFChneein2Cuminhamburgsbekanntestemkieztheatergemeinsammitihneneinenfulminantenabendzuerleben.0D0AinheimeligeratmosphE4rewirdgesungen2Cgetrunken2Cgeplaudert2Cimprovisiertundmusiziert2Cunddaspublikumistganznahmitdabei.0D0Azu84freudenschussplus8593kommtmanalsgastundgehtalsfreund.0D0Adiesmaldabei3Aregyclasen2Ccarrington-brownundrolfclausen&url=pinupaz.bid20 pin-up kazino pinup az pin-up oyunu and pin-up oyunu pinup azerbaycan
StanleyGlabs
пин ап пин ап кз or пин ап 634 https://clients1.google.li/url?q=http://pinupkz.tech пинап казино пин ап пинап кз and pin up казино пин ап 634
Forrestbub
pin up: pin up giris – pin up
SantoCog
https://pinupkz.tech/# пин ап 634
Samuelgreak
https://zithromax.company/# zithromax 500
NicolasBep
http://gabapentin.auction/# neurontin 100mg price
NicolasBep
https://stromectol.agency/# ivermectin 8000 mcg
MatthewPhode
can i buy amoxicillin online: how to buy amoxicillin online – amoxicillin online canada
NicolasBep
https://semaglutide.win/# Buy semaglutide pills
StevenFag
http://zithromax.company/# generic zithromax azithromycin buy zithromax without prescription online
NicolasBep
https://amoxil.llc/# buy amoxicillin 250mg
Samuelgreak
https://semaglutide.win/# order Rybelsus for weight loss
NicolasBep
https://gabapentin.auction/# gabapentin
StevenFag
http://semaglutide.win/# Buy semaglutide pills zithromax capsules 250mg
Samuelgreak
https://semaglutide.win/# Rybelsus 7mg
MatthewPhode
stromectol price in india: stromectol for sale – minocycline 50 mg
Michaelmit
buy zithromax 1000 mg online order zithromax zithromax online paypal
ElvisBex
Rybelsus 14 mg price rybelsus cost or Buy compounded semaglutide online https://www.winplc7.com/download.php?Link=https://semaglutide.win/ order Rybelsus for weight loss Rybelsus 14 mg price Rybelsus 14 mg and Buy compounded semaglutide online buy semaglutide online
NicolasBep
http://gabapentin.auction/# buy generic neurontin online
Michaelmit
where to buy amoxicillin cheapest amoxil amoxicillin canada price
Kennethraw
neurontin 300 mg coupon where can i buy neurontin from canada or can i buy neurontin over the counter https://smootheat.com/contact/report?url=https://gabapentin.auction neurontin 100mg capsule price neurontin brand name 800mg drug neurontin 200 mg and canada neurontin 100mg discount neurontin cap 300mg price
NicolasBep
https://gabapentin.auction/# canada where to buy neurontin
process server near barataria la
Hi, Neat post. There is a problem together with your website in web explorer, could test this?K IE still is the marketplace leader and a huge element of people will pass over your wonderful writing due to this problem.
MatthewPhode
zithromax generic price: zithromax for sale – buy generic zithromax no prescription
NicolasBep
http://zithromax.company/# can you buy zithromax over the counter in australia
ElvisBex
rybelsus generic cheap Rybelsus 14 mg or semaglutide https://www.google.td/url?q=https://semaglutide.win Buy compounded semaglutide online Rybelsus 14 mg price rybelsus cost and Semaglutide pharmacy price Buy compounded semaglutide online
Michaelmit
neurontin cap 300mg buy gabapentin canada where to buy neurontin
Michaelmit
amoxicillin 500mg over the counter amoxicillin cheapest price amoxicillin 500mg no prescription
Adrzrq
order amoxiclav without prescription – buy levothroid tablets buy cheap generic synthroid
Michaelmit
Buy compounded semaglutide online cheap Rybelsus 14 mg buy rybelsus
ElvisBex
rybelsus generic cheap Rybelsus 14 mg or cheap Rybelsus 14 mg https://www.google.cv/url?q=https://semaglutide.win rybelsus price rybelsus semaglutide and Buy semaglutide pills buy semaglutide online
MatthewPhode
buy rybelsus: rybelsus price – buy semaglutide online
NicolasBep
https://gabapentin.auction/# neurontin tablets
StevenFag
https://amoxil.llc/# amoxicillin 500 mg purchase without prescription how to buy zithromax online
MatthewPhode
zithromax 500: zithromax best price – buy zithromax
Samuelgreak
http://zithromax.company/# buy cheap zithromax online
AgustinPhamn
http://indianpharmdelivery.com/# indian pharmacy online pharmacy website india
GregorySlams
best over the counter ed pills http://drugs24.pro/# best drug for ed
Dennisgusty
indian pharmacy online: cheapest online pharmacy india – pharmacy website india
GregorySlams
top ed drugs https://drugs24.pro/# best pharmacy online
AgustinPhamn
http://indianpharmdelivery.com/# buy prescription drugs from india world pharmacy india
Dennisgusty
indian pharmacy paypal: india pharmacy – india pharmacy mail order
Rogerneest
the canadian drugstore canadian drugs or buy prescription drugs from canada cheap https://maps.google.nu/url?sa=t&url=https://drugs24.pro how to cure ed canadian drugs pain meds online without doctor prescription and ed dysfunction over the counter erectile dysfunction pills
BrandonNuato
top online pharmacy india indian pharmacies safe reputable indian pharmacies
Dennisgusty
Online medicine home delivery: online shopping pharmacy india – indian pharmacy paypal
AgustinPhamn
http://mexicanpharm24.pro/# mexican drugstore online top online pharmacy india
Billyjeoms
mexican border pharmacies shipping to usa medicine in mexico pharmacies or purple pharmacy mexico price list http://pinnest.com/source/mexicanpharm24.pro/ pharmacies in mexico that ship to usa mexican rx online purple pharmacy mexico price list and buying prescription drugs in mexico mexico drug stores pharmacies
RichardFab
mail order pharmacy india: india pharmacy – Online medicine home delivery
BrandonNuato
pharmacies in mexico that ship to usa mexican pharmaceuticals online medicine in mexico pharmacies
Dennisgusty
indian pharmacies safe: reputable indian pharmacies – india online pharmacy
AgustinPhamn
https://indianpharmdelivery.com/# best online pharmacy india cheapest online pharmacy india
Dennisgusty
mexican drugstore online: buying prescription drugs in mexico – mexico drug stores pharmacies
DannyBiomo
ed solutions viagra without doctor prescription amazon or 100mg viagra without a doctor prescription https://cse.google.sm/url?q=https://drugs24.pro best ed pills compare ed drugs drugs for ed and can ed be cured best male enhancement
AgustinPhamn
http://drugs24.pro/# drugs online reputable indian online pharmacy
BrandonNuato
reputable indian pharmacies world pharmacy india indian pharmacy online
GregorySlams
errectile dysfunction https://drugs24.pro/# ed drug comparison
DavidSweri
Online medicine home delivery top 10 online pharmacy in india or top 10 online pharmacy in india https://maps.google.co.mz/url?q=https://indianpharmdelivery.com best india pharmacy top online pharmacy india india pharmacy and india online pharmacy indian pharmacy
BrandonNuato
mexican border pharmacies shipping to usa mexico pharmacies prescription drugs mexico drug stores pharmacies
Billyjeoms
mexican pharmaceuticals online mexican pharmaceuticals online or mexican drugstore online http://www.red-ring.com/rssnewsitem.php?urltodisplay=http://mexicanpharm24.pro mexico drug stores pharmacies mexico drug stores pharmacies mexican drugstore online and medication from mexico pharmacy buying prescription drugs in mexico
Trentbuime
https://rybelsus.icu/# order Rybelsus ed symptoms
Charlesinjep
good price: semaglutide – rybelsus
Arthurfrard
http://stromectol1st.shop/# stromectol price usa п»їlegitimate online pharmacies india
Travisduawl
buy rybelsus: Buy semaglutide – rybelsus
Trentbuime
http://clopidogrel.pro/# generic plavix male dysfunction treatment
RichardGaw
stromectol nz buy online minocycline 50 mg tablets for human
Charlesinjep
buy paxlovid online: check this – paxlovid for sale
Travisduawl
paxlovid for sale: paxlovid pharmacy – Paxlovid buy online
Sergiogaure
п»їplavix generic Cost of Plavix on Medicare or buy plavix http://www.whatmusic.com/info/productinfo.php?menulevel=home&productid=288&returnurl=http://clopidogrel.pro plavix best price Clopidogrel 75 MG price Cost of Plavix without insurance and plavix best price Plavix 75 mg price
Michaeljal
buy minocycline 50 mg otc stromectol 3mg tablets or ivermectin 0.5 lotion https://www.google.gy/url?q=https://stromectol1st.shop minocycline hcl oral ivermectin cost ivermectin pill cost and minocycline 50mg tablets for humans for sale minocycline 50 mg
Trentbuime
https://clopidogrel.pro/# Plavix generic price buy ed pills online
BernardMef
semaglutide Buy semaglutide or Semaglutide pharmacy price https://www.google.com.np/url?q=https://rybelsus.icu rybelsus price order Rybelsus rybelsus price and cheaper rybelsus generic
RichardGaw
rybelsus generic Buy semaglutide cheaper
Tbqkpl
buy cozaar 25mg pills – buy keflex 125mg generic buy keflex 250mg generic
Charlesinjep
Paxlovid buy online: paxlovid shop – paxlovid price
Travisduawl
rybelsus.icu: buy semaglutide online – rybelsus cost
Trentbuime
http://rybelsus.icu/# order Rybelsus real viagra without a doctor prescription
Colindycle
paxlovid cost without insurance paxlovid generic or Paxlovid buy online https://images.google.vg/url?sa=t&url=https://paxlovid1st.shop paxlovid covid Paxlovid buy online paxlovid price and paxlovid price paxlovid price
RichardGaw
minocycline uses best price shop minocycline 100 mg without doctor
Arthurfrard
http://stromectol1st.shop/# stromectol nz online pharmacy india
Charlesinjep
Paxlovid over the counter: shop – paxlovid india
Travisduawl
more: rybelsus – rybelsus cost
Trentbuime
https://clopidogrel.pro/# buy Clopidogrel over the counter buy anti biotics without prescription
RichardGaw
generic ivermectin stromectol 1st cost of ivermectin medicine
Michaeljal
ivermectin drug ivermectin 6mg dosage or minocycline tablets http://www.huranahory.cz/sleva/pobyt-pec-pod-snezko-v-penzionu-modranka-krkonose/343?show-url=https://stromectol1st.shop/ minocycline 50 mg tablet order minocycline 100mg ivermectin 1 cream 45gm and ivermectin ebay minocycline rash
Charlesinjep
buy rybelsus: more – more
Colindycle
Paxlovid over the counter buy paxlovid online or paxlovid generic http://www.virtual-egypt.com/framed/framed.cgi?url==http://paxlovid1st.shop buy paxlovid online Paxlovid over the counter paxlovid india and paxlovid covid paxlovid covid
Arthurfrard
http://stromectol1st.shop/# minocycline 100 mg tabs buy prescription drugs from india
Charlesinjep
Plavix 75 mg price: clopidogrel pro – generic plavix
Arthurfrard
https://stromectol1st.shop/# ivermectin 80 mg п»їlegitimate online pharmacies india
Travisduawl
buy Clopidogrel over the counter: clopidogrel pills – generic plavix
BernardMef
rybelsus cheaper or rybelsus.icu https://maps.google.ng/url?q=https://rybelsus.icu good price more Semaglutide pharmacy price and Semaglutide pharmacy price Semaglutide pharmacy price
Sergiogaure
buy clopidogrel bisulfate plavix medication or Clopidogrel 75 MG price http://www.ixawiki.com/link.php?url=https://clopidogrel.pro Clopidogrel 75 MG price buy clopidogrel bisulfate Clopidogrel 75 MG price and buy plavix buy plavix
Charlesinjep
paxlovid india: buy here – paxlovid pharmacy
Trentbuime
http://rybelsus.icu/# rybelsus.icu legal to buy prescription drugs without prescription
Michaeljal
stromectol generic name ivermectin 0.08 oral solution or ivermectin 3mg tab http://barysh.org/bitrix/rk.php?id=14&goto=http://stromectol1st.shop stromectol buy ivermectin nz stromectol 12mg online and minocycline 50 mg tablets for humans for sale buy stromectol canada
Colindycle
Paxlovid buy online paxlovid buy or paxlovid generic http://7ba.ru/out.php?url=https://paxlovid1st.shop::: paxlovid india paxlovid for sale paxlovid india and paxlovid pill paxlovid pharmacy
RichardGaw
paxlovid india paxlovid for sale Paxlovid over the counter
Travisduawl
Plavix 75 mg price: generic pills – buy plavix
Arthurfrard
https://stromectol1st.shop/# ivermectin new zealand india pharmacy mail order
Charlesinjep
Plavix generic price: clopidogrel – п»їplavix generic
RichardGaw
ivermectin over the counter canada stromectol shop buy stromectol online uk
Travisduawl
ivermectin usa price: ivermectin cost – generic ivermectin