Émergence de la Dermatose Nodulaire Contagieuse en France : situation épidémiologique, diagnostic et stratégies de contrôle
Auteurs : Baptiste Demey1, Kristel Gache2, Sylvain Brisse3
Affiliations :
1 Laboratoire AGIR – Agents Infectieux Résistance et Chimiothérapie, Université Picardie Jules Verne ; Laboratoire de Virologie – CHU Amiens-Picardie, Amiens, France ; Section Epidémiologie et Génomique des Populations de la Société Française de Microbiologie
2 Fédération Nationale des Groupements de Défense Sanitaire (GDS France)
3 Institut Pasteur, Unité Biodiversité et Epidémiologie des Bactéries Pathogènes, Paris, France ; Section Epidémiologie et Génomique des Populations de la Société Française de Microbiologie
Date : 08 janvier 2026
Mots-clés : Dermatose Nodulaire Contagieuse, LSDV, Émergence, Génomique, Epidémiologie.
1. Introduction
La Dermatose Nodulaire Contagieuse (DNC), ou Lumpy Skin Disease (LSD) en anglais, est une maladie virale bovine majeure, endémique en Afrique, en Asie et au Moyen-Orient. Causée par le virus de la DNC (LSD Virus, LSDV), elle se caractérise par un fort impact en termes de santé et bien-être animal, et des pertes économiques majeures (chute de production laitière, lésions cutanées, mortalité). Découverte en Zambie en 1929, la DNC est restée endémique dans plusieurs pays d’Afrique subsaharienne pour émerger à partir de 1988 en Égypte, puis en Turquie et dans les pays des Balkans à partir de 2015. Après une forte propagation en 2016 dans sept pays des Balkans (Grèce, Bulgarie, Macédoine du Nord, Serbie, Kosovo, Albanie, Monténégro), la mise en œuvre de campagnes coordonnées de vaccination massive a permis de contenir puis d’éliminer la maladie dans la région à partir de 2017. Plus récemment, la DNC s’est déclarée en Libye en juin 2023. En juin 2024, l’Algérie a déclaré ses deux premiers foyers de DNC puis, rapidement, la maladie s’est répandue dans plusieurs régions de la Tunisie. L’introduction de la maladie en Europe de l’Ouest date de l’été 2025 : la DNC est déclarée le 22 juin 2025 en Italie (en Sardaigne puis en Lombardie) puis le 29 juin 2025 en Savoie, pour la première fois en France hexagonale.
Dans cet article, nous faisons le point sur la situation épidémiologique en France au 7 Janvier 2026 et présentons le virus, la transmission de la maladie, son diagnostic et les moyens de contrôle.
2. Caractéristiques du virus et évolution génomique
Le LSDV appartient au genre Capripoxvirus (famille des Poxviridae). Son génome est constitué d’un ADN double brin linéaire d’environ 151 kbp. Les analyses phylogénétiques confirment que la souche circulant en France en 2025 est liée à la lignée Nigeria 2018 (Clade 1.2), surnommée « Nigeria-Méditerranée » (Figure 1). Contrairement aux souches du clade 2 observées en Asie, cette souche a progressé via l’axe nord-africain (Libye, Algérie, Tunisie) avant d’atteindre la Sardaigne, puis le continent européen.
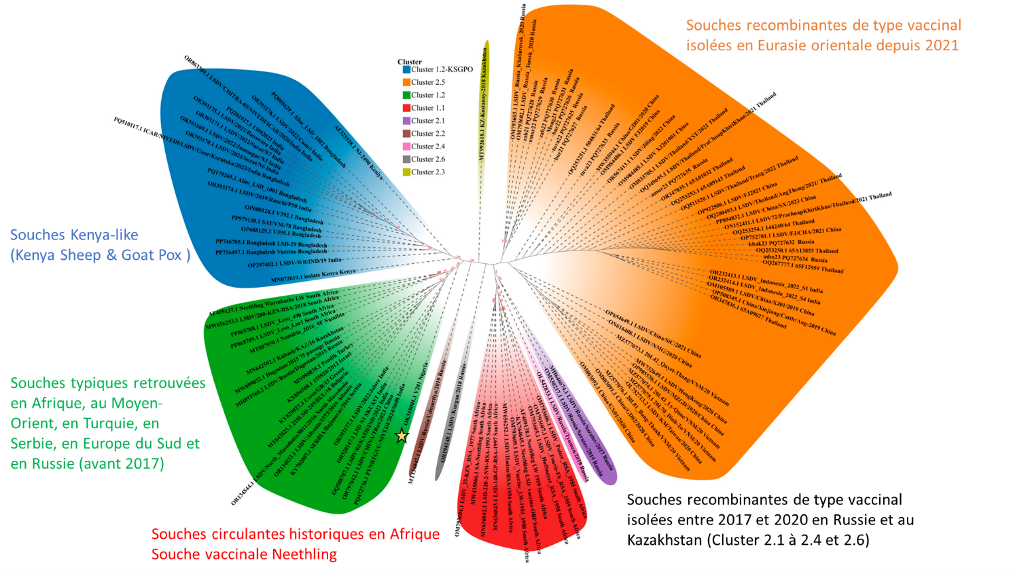
Figure 1 : Arbre phylogénétique basé sur le séquençage du génome entier entre souches de LSDV isolées. L’étoile met en valeur la souche typiquement retrouvée en France actuellement. Adapté de Sprigyn et al. (2025).
Des mutations spécifiques dans la souche circulante ont été principalement identifiées dans les gènes codant pour les protéines membranaires P32 et les récepteurs couplés aux protéines G (RCPG). La souche Neethling est le virus prototype qui a été isolé il y a plusieurs décennies en Afrique du Sud et qui a permis le développement d’un vaccin vivant atténué, reconnu très efficace sur les souches historiques de clade 1 et les autres souches de LSDV, dont les recombinantes d’apparition récente (Kumar et al. 2025).
3. Transmission et épidémiologie en France
La transmission de la DNC est majoritairement vectorielle. Les deux vecteurs principaux sont les stomoxes (mouches piqueuses) et les taons. Ces insectes sont hématophages et transmettent le virus responsable de la DNC de manière mécanique : ils infectent leurs pièces buccales lors d’un repas de sang, qui peut être interrompu (ce qui arrive fréquemment, le bovin réagissant à la piqûre). La poursuite du repas de sang sur un autre bovin est ainsi responsable de la transmission du virus. La transmission peut aussi se faire par contact avec les sécrétions, croûtes, salive, lait d’animaux infectés ou le matériel contaminé.
Une problématique importante qui rend le contrôle difficile est le rôle des animaux asymptomatiques dans la transmission. En effet, la transmission du LSDV par les mouches Stomoxys calcitrans provenant de bovins subcliniques (sans nodules cutanés) à des bovins naïfs a été démontrée (Haegeman et al. 2023). Dans une autre étude, plus de deux tiers des biopsies cutanées prélevées sur des animaux infectés de manière subclinique par le LSDV se sont révélées positives au génome viral par PCR (Aerts et al. 2021), ce qui suggère également un rôle possible de ces animaux asymptomatiques dans la transmission de la maladie. Cette possibilité de transmission à partir d’animaux asymptomatiques et l’impossibilité de détecter ces animaux avec des outils de dépistage (virémie faible et fluctuante) indiquent l’importance de l’élimination de l’ensemble des animaux du troupeau lors de la détection d’un cas.
Le CIRAD (Centre de coopération internationale en recherche agronomique pour le développement) est désigné depuis 2009 par la Direction Générale de l’Alimentation comme Laboratoire National de Référence pour le diagnostic de la DNC. En raison du contexte épidémiologique, les laboratoires départementaux des régions touchées (Ain, Savoie, Pyrénées-Orientales) ont pu bénéficier d’un agrément pour réaliser le dépistage viral. Au 7 janvier 2026, la France dénombre 117 foyers confirmés répartis dans 11 départements sur trois régions : Auvergne-Rhône-Alpes (AURA), Bourgogne-Franche-Comté (BFC) et Occitanie Si la situation semble stabilisée en région AURA et BFC, la situation reste sous étroite surveillance en Occitanie, (arc pyrénéen). Cette zone est caractérisée par une dynamique préoccupante depuis octobre dans les Pyrénées-Orientales, l’Aude et l’Ariège, suggérant soit une introduction transfrontalière depuis la Catalogne (Espagne) (source : Bulletin de Veille Sanitaire Internationale de la Plateforme ESA) soit des mouvements non contrôlés de bétail depuis d’autres zones touchées, qui expliqueraient ces “sauts de distance” entre les foyers français selon la Direction Générale de l’Alimentation et le Ministère de l’Agriculture.
Conformément au Règlement délégué (UE) 2020/687, la France applique une politique de « stamping-out » (dépeuplement total du troupeau) dès confirmation d’un cas, complétée par un zonage strict de 50 kms autour des foyers. On parle alors de « Zones réglementées » dans lesquelles les restrictions de bovins sont mises en place, associées à des mesures de vaccination obligatoire. La vaccination peut également être mise en place dans des territoires situés au-delà de ces zones règlementées, à titre uniquement préventif on parle alors de « Zone Vaccinale I » (c’est le cas de la Corse et d’un certain nombre de départements de la région Occitanie).
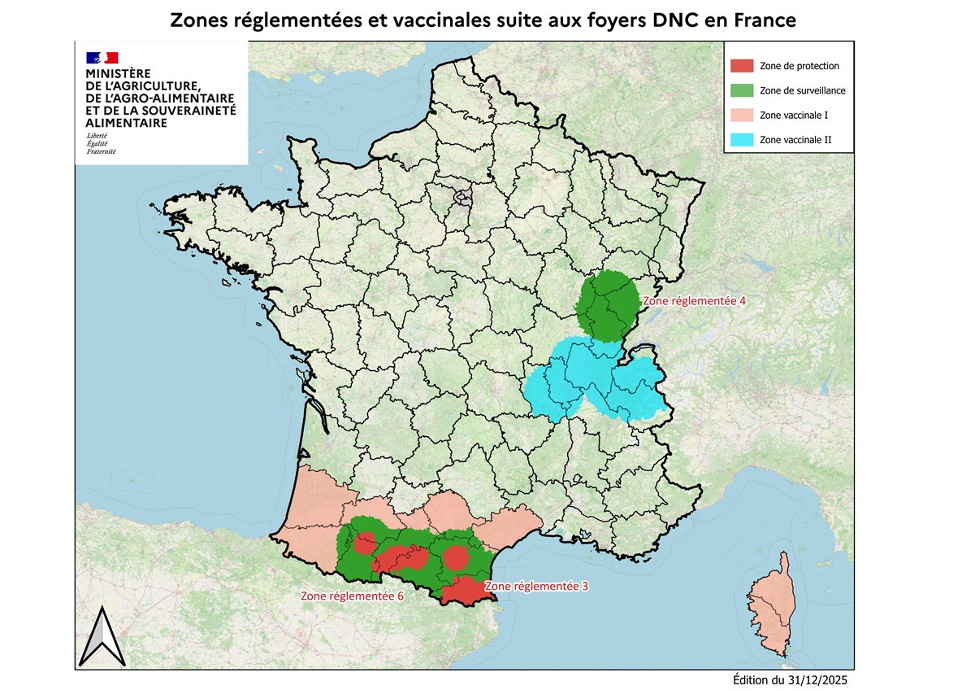
Figure 2 : Zones réglementées et vaccinales en France au 31/12/2025 (source : Ministère de l’Agriculture, de l’Agro-Alimentaire et de la Souveraineté Alimentaire).
4. Techniques de diagnostic et tests PCR différenciant le vaccin des souches sauvages
L’utilisation de vaccins vivants atténués (souche Neethling) pose un défi diagnostique majeur : la difficulté de distinguer un animal infecté par la souche sauvage, d’un animal vacciné. En 2025, la France a déployé une stratégie DIVA (Differentiating Infected from Vaccinated Animals) reposant sur deux piliers technologiques :
D’une part, la PCR en temps réel est désormais la technique de première intention. Les kits commerciaux sont facilement accessibles en 2025. Ils reposent sur différentes stratégies moléculaires concernant le choix des portions de gènes cibles, et donc des amorces et sondes. Auparavant, la PCR classique permettait de détecter la présence du gène P32 codant pour la protéine majeure de capside. Cependant, ce gène est très conservé entre les différentes espèces de Capripoxvirus et ne permet pas le diagnostic différentiel avec le Sheep Pox virus (SPPV) ou le Goat Pox virus (GTPV) donnant des infections cliniquement similaires pour ces espèces animales, ni entre une infection réelle à LSDV ou une vaccination récente. En revanche, la PCR de type DIVA permet ce type de distinction. Les souches de LSDV atténuées utilisées pour la vaccination sont caractérisées par des mutations majeures principalement situées dans les régions terminales variables, qui codent pour les gènes de virulence. La souche vaccinale Neethling présente de nombreuses délétions d’une à plusieurs dizaines de nucléotides au sein des séquences de gène de virulence. Par exemple, la stratégie DIVA développée par Agianniotaki et al. (2017) repose sur les variations de la séquence du gène du RCPG en utilisant un seul couple d’amorces et deux sondes détectant chacune soit le LSDV sauvage ou le LSDV vaccinal (Neethling) (Figure 3). D’autres gènes (gène de la DNA-ligase-like, gène de la protéine kelch-like, etc.) peuvent également être ciblés de cette manière, ou en adaptant à une stratégie de PCR multiplexe détectant à la fois les régions conservées et les régions mutées (Byadovskaya et al. 2020 ; Vidanovic et al. 2021 ; Haegman et al. 2023).
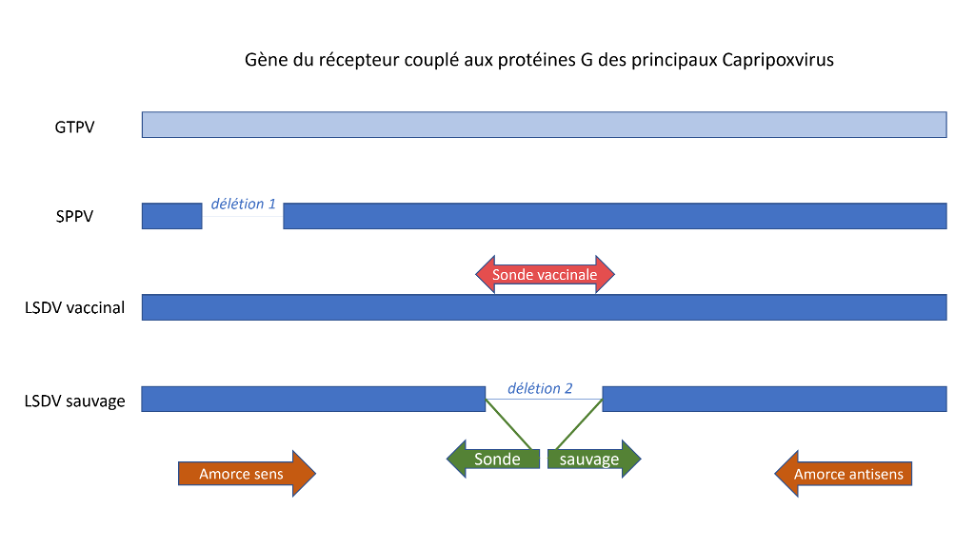
Figure 3 : Représentation schématique de la méthode par PCR temps réel, adaptée de Agianniotaki et al. (2017). Cette stratégie permet de distinguer la présence de Goat Pox virus (GTPV), Sheep Pox Virus (SPPV), Lumpy Skin Disease Virus (LSDV) vaccinal ou sauvage par la détection du gène du récepteur couplé aux protéines G. La séquence du GTPV n’est pas reconnue par le test. Le gène du SSPV ne permet que la fixation de l’amorce antisens. La sonde “vaccinale” permet la détection de la séquence non délétée dans le gène de la souche vaccinale. La sonde “sauvage” reconnait la séquence chevauchant la portion délétée dans le LSDV sauvage.
D’autre part, le séquençage Nanopore permet aussi une discrimination entre souches infectieuses et vaccinale. Dans le cas de suspicion clinique en élevage vacciné, ces différentes techniques permettent de confirmer en moins de 24h si la détection sur prélèvements correspond à une souche vaccinale ou à une infection par le virus circulant. Cette précision est vitale pour éviter l’abattage injustifié de troupeaux suspectés de dermatose nodulaire mais présentant en réalité une réaction vaccinale bénigne.
5. La vaccination
La vaccination constitue un pilier central de la riposte française, en absence de traitement curatif approuvé cliniquement.
Le vaccin vivant atténué (souche Neethling) reste le seul capable d’induire une protection rapide et robuste. En France, plus de 1,5 million de doses ont été administrées entre juin et décembre 2025. Bien qu’efficace, ce vaccin peut provoquer des effets secondaires pouvant « mimer » la maladie, comme l’apparition d’un ou plusieurs nodules à distance du point d’injection, compliquant le diagnostic clinique sur le terrain. La stratégie de diagnostic DIVA (voir ci-dessus) est donc essentielle.
L’immunité protectrice n’est considérée comme acquise qu’après un délai de 21 jours post-injection. Certains foyers ont ainsi concerné des animaux vaccinés, avec des bovins qui se sont contaminés avant que la protection apportée par le vaccin ne soit optimale.
Les poxvirus induisent à la fois une réponse immunitaire à médiation cellulaire et une réponse immunitaire à médiation par les anticorps. Les bovins développent des anticorps neutralisants anti-LSDV, tant après la vaccination qu’après avoir contracté l’infection naturelle. La persistance des anticorps après la vaccination ou une infection naturelle varie d’un individu à l’autre. La durée précise des réponses immunitaires protectrices après la vaccination ou une infection naturelle reste incertaine.
6. Impacts économiques et risque sanitaire
La vaccination ne lève pas immédiatement les interdictions commerciales. Un animal vacciné (depuis au moins 28 jours) ne peut circuler en zone « indemne » uniquement si l’immunité collective a été atteinte dans la zone géographique concernée (75% des bovins dans 95% des établissements). Pour les envois vers d’autres États Membres de l’UE, chaque pays doit également donner son accord pour accueillir des bovins vaccinés.
L’épizootie de 2025 constitue une épreuve pour la filière bovine française, et une crise devenue médiatique et politique. Dans les exploitations affectées, le coût de dépeuplement total est compensé par l’État, mais la perte du capital génétique et le délai de reconstitution des troupeaux limitent l’acceptabilité des mesures mises en place. De plus, les restrictions de mouvements de bovins ont un impact économique majeur pour les éleveurs des zones touchées.
D’un point de vue commercial, la détection de foyers de DNC en France a entraîné la fermeture immédiate de certains marchés avec les pays tiers pour les bovins vivants, les produits laitiers ou encore les semences et embryons.
Enfin, pour l’Etat, les mesures de gestion de cette crise (vaccination obligatoire, visites vétérinaires, nettoyage et désinfection des élevages foyers, indemnisation des élevages touchés) ont également un coût considérable.
Un point crucial pour la communication publique en 2025 a été la gestion de l’inquiétude des consommateurs. Il est essentiel de rappeler l’absence de caractère zoonotique du virus : il est scientifiquement établi que le virus de la DNC n’est pas transmissible à l’homme. Contrairement au virus mpox, le LSDV possède une spécificité d’hôte très étroite limitée aux ruminants (principalement bovins et buffles).
7. Conclusion et perspectives
L’émergence du LSDV et de la DNC en France souligne l’impact de la globalisation des échanges et du changement climatique, favorisant la survenue de maladies vectorielles. Les enjeux de 2026 incluront de maintenir une vigilance et une adhésion forte de l’ensemble des acteurs (éleveurs et vétérinaires) pour parvenir à l’objectif d’éradication du virus sur notre territoire.
8. Références Officielles
- Organisation Mondiale de la Santé Animale (OMSA) : Portail technique sur la Dermatose Nodulaire Contagieuse
- ANSES (Agence Nationale de Sécurité Sanitaire) : Avis relatif à l’évaluation des risques liés à l’introduction du LSDV en France
- Plateforme ESA (Épidémiosurveillance Santé Animale) : Bulletins de veille sanitaire internationale (VSI) – Suivi des foyers DNC
- Commission Européenne : Règlement délégué (UE) 2020/687 concernant les mesures de lutte contre les maladies réputées contagieuses
- EFSA (European Food Safety Authority) : Scientific reports on Lumpy Skin Disease spread and vaccination effectiveness in Europe
Laboratoire National de Référence (Poxvirus des ruminants, dont dermatose nodulaire contagieuse, clavelée et variole caprine) : https://umr-astre.cirad.fr/fr/expertises/activites-de-reference/laboratoire-national-de-reference
9. Références Scientifiques
- Kumar, N., Sharma, S. & Tripathi, B. N. Pathogenicity and virulence of lumpy skin disease virus: A comprehensive update. Virulence 16, 2495108 (2025).
- Sprygin, A. et al. Whole Genome Sequencing of Lumpy Skin Disease Virus from 2021–2023 in Eastern Eurasia Reveals No More Recombination Signals in the Circulating Pool of Strains. Viruses 17, 468 (2025).
- Agianniotaki, E. I. et al. Development and validation of a TaqMan probe-based real-time PCR method for the differentiation of wild type lumpy skin disease virus from vaccine virus strains. Journal of Virological Methods 249, 48–57 (2017).
- Haegeman, A. et al. Evidence of Lumpy Skin Disease Virus Transmission from Subclinically Infected Cattle by Stomoxys calcitrans. Viruses 15, (2023).
- Aerts, L. et al. Detection of Clinical and Subclinical Lumpy Skin Disease Using Ear Notch Testing and Skin Biopsies. Microorganisms 9, (2021).
- Byadovskaya, O. et al. Performance of the currently available DIVA real-time PCR assays in classical and recombinant lumpy skin disease viruses. Transboundary and Emerging Diseases 68, 3020–3024 (2021).
- Vidanović, D. et al. Validation of TaqMan-Based Assays for Specific Detection and Differentiation of Wild-Type and Neethling Vaccine Strains of LSDV. Microorganisms 9, (2021).
- Haegeman, A., De Leeuw, I., Philips, W. & De Regge, N. Development and Validation of a New DIVA Real-Time PCR Allowing to Differentiate Wild-Type Lumpy Skin Disease Virus Strains, Including the Asian Recombinant Strains, from Neethling-Based Vaccine Strains. Viruses 15, 870 (2023).








