La taxonomie des souches bactériennes à l’heure de la génomique
Mélanie Hennart1, Alexis Criscuolo2 et Sylvain Brisse1,2
1. Institut Pasteur, Université Paris Cité, Unité Biodiversité et Épidémiologie des Bactéries Pathogènes, F-75015 Paris, France
2. Institut Pasteur, Université Paris Cité, Centre de Ressources Biologiques de l’Institut Pasteur, F-75015 Paris, France
Introduction
Pour permettre la communication entre les différents acteurs de la surveillance épidémiologique, il est important de disposer de systèmes précis de classification et de nommage des souches bactériennes circulantes, ainsi que de leurs variants potentiellement pathogènes. La taxonomie (au sens de la systématique des organismes vivants) peut se décomposer en trois opérations complémentaires et interdépendantes : la classification, la nomenclature et l’identification. Tout comme pour les organismes eucaryotes pluricellulaires, la taxonomie procaryote est basée sur le système linnéen (i.e. phylum, classe, ordre, famille, genre, espèce, sous-espèce). Cette taxonomie ne prend donc pas du tout en compte des niveaux plus fins que la sous-espèce (phylogroupes, lignées, souches, clones …). Pourtant, des lignées phylogénétiques distinctes au sein de nombreuses (sous-)espèces microbiennes peuvent posséder des propriétés très différentes en termes d’écologie ou de pathogénicité. Un exemple bien connu est l’espèce Escherichia coli, qui comprend des souches commensales (et même probiotiques) ainsi que des souches très pathogènes (comme celles responsables du syndrome hémolytique et urémique [SHU]). En conséquence, pour déterminer et reconnaître les agents bactériens à haut risque de pathogénicité, et tracer les variants durant les évènements épidémiques, des solutions taxonomiques plus fines (au niveau des souches) sont nécessaires. Différents systèmes ont ainsi été utilisés pour distinguer les souches depuis les débuts de la microbiologie, comme les sérotypes, phagotypes, ribotypes ou autres ‘types’. Toutefois, avec la disponibilité récente des outils de séquençage génomique et la démocratisation de leur emploi, ces premiers systèmes tendent à disparaître au profit de nouvelles taxonomies à l’échelle des génomes.
Cet article présentera différents nouveaux systèmes de taxonomie génomique des souches bactériennes. Dans un article précédent (https://www.sfm-microbiologie.org/2023/02/14/comparaison-des-sequences-genomiques-pour-la-surveillance-epidemiologique-et-linvestigation-depidemies-3-approches-complementaires/), trois stratégies de comparaison de souches et de caractérisation de populations microbiennes ont été présentées : les approches gène-par-gène (Multi-Locus Sequence Typing; MLST), les techniques s’articulant sur les polymorphismes nucléotidiques (Single Nucleotide Polymorphisms; SNPs), et les méthodes basées sur les k-mers (oligonucléotides de longueur fixe k). Même si les stratégies basées sur les SNPs ou les k-mers ont permis, dans certains cas particuliers, de développer des taxonomies de souches (Wong et al. 2016; Lees et al. 2019; Dyson and Holt 2021; Hawkey et al. 2021), le typage MLST (Maiden et al. 1998; Achtman et al. 2012) demeure, pour les souches bactériennes, le système le plus généralisable et le plus utilisé en pratique. Son adaptation au core genome (cgMLST) a permis d’étendre les avantages bien établis de l’approche MLST à l’échelle génomique (Jolley and Maiden, 2010; Maiden et al., 2013). Ainsi, le typage cgMLST fournit une précision accrue, permettant une discrimination des souches à des niveaux beaucoup plus fins, notamment entre les isolats d’une même souche épidémique. Le présent article présentera donc uniquement les classifications et les nomenclatures associées aux approches gène-par-gène.
Le « Sequence Type » et son extension au core-genome MLST
Le « Sequence Type » (ST, que l’on pourrait traduire par « séquençotype ») est un génotype défini par l’approche MLST, traditionnellement fondée sur les séquences internes de ℓ = 7 gènes conservés dans une espèce donnée. Pour chacun des ℓ gènes, un numéro (entier) distinct est attribué à chaque nouvelle séquence nucléotidique (allèle) observée parmi les isolats. Pour chaque isolat, la combinaison des ℓ numéros d’allèles définit son profil allélique. Le ST étant un identifiant numérique unique attribué à chaque profil allélique complet, la classification des souches s’effectue via leur regroupement par ST. Du fait de la reproductibilité et de la portabilité de ce système, les classifications MLST se sont imposées comme des standards en biologie des populations et en épidémiologie des bactéries pathogènes, (e.g. https://pubmlst.org, https://enterobase.warwick.ac.uk, https://bigsdb.pasteur.fr). La liste des ST d’une espèce donnée représente donc une véritable nomenclature qui a été largement adoptée par les communautés des chercheurs et des acteurs de la surveillance épidémiologique des maladies infectieuses (Enright and Spratt 1999; Feil 2004; Achtman et al. 2012; Maiden et al. 2013).
Avec la démocratisation du séquençage à haut-débit des génomes, l’approche MLST a été logiquement étendue à l’échelle du core genome (cgMLST), le core genome étant l’ensemble des gènes partagés par tous les membres d’une espèce ou d’un groupe d’espèces. De façon analogue à la classification par ST, chaque profil cgMLST distinct (souvent appelé cgST) peut être répertorié. Toutefois, la différence majeure par rapport à l’approche MLST est l’existence potentielle de données manquantes au sein des profils cgMLST, du fait d’événements de délétions de gène, mais aussi de problèmes de séquençage (par exemple, faible profondeur de couverture locale) et/ou d’assemblage des séquences génomiques (gènes interrompus à l’extrémité d’un contig). Ainsi, des cgSTs ne différant que par des identifiants alléliques manquants pouvant coexister dans une nomenclature basée sur l’approche cgMLST, un même isolat peut être associé à plusieurs cgSTs différents.
Le regroupement des profils alléliques selon leur ressemblance
Une des limitations du génotypage basé sur l’entièreté du profil allélique est que les relations phylogénétiques entre souches ne sont pas déductibles à partir de simples identifiants (cg)ST. Ainsi, chez Klebsiella pneumoniae, les souches classifiées ST23 et ST57 sont connues pour être phylogénétiquement très proches, mais les numéros de ces deux ST ne traduisent pas cette information de proximité évolutive. Pour pallier cet aspect « typologiste » du (cg)ST, les profils alléliques peuvent être regroupés selon leur ressemblance. Cette approche a été concrétisée pour les profils MLST avec la notion de Complexe Clonal (CC), défini par l’ensemble des STs différant par un seul allèle d’au moins un autre ST du même CC. Ces regroupements en CC se sont avérés particulièrement utiles pour des pathogènes peu recombinogènes tels que Listeria monocytogenes ou Staphylococcus aureus, car les groupes d’isolats ainsi inférés sont génétiquement homogènes et bien séparés les uns des autres (Turner and Feil 2007; Ragon et al. 2008). Cependant, chez d’autres espèces telle que K. pneumoniae, la classification en CC s’est avérée vaine voire trompeuse, car de nombreuses paires de STs ne diffèrent que par un seul allèle (sur sept), produisant un effet de chaînage regroupant de manière trompeuse la plupart des STs dans un même CC très hétérogène (Turner et al. 2007; Brisse et al. 2009).
En généralisant cette approche par ressemblance à n’importe quel nombre de différences alléliques entre profils, des groupements de souches peuvent être définis pour tout niveau de divergence. Ainsi, dans l’approche cgMLST, des groupes de profils, parfois appelés groupes clonaux (Clonal Groups; CGs), sont déterminés en étendant la définition du CC à un seuil prédéfini appliqué à une dissimilarité entre profils (souvent estimée par la proportion d’allèles non-manquants différents). Cette méthode de détermination des CGs est souvent nommée classification Single Linkage (Slink; cf. Note technique).
Note technique
L’ensemble des dissimilarités entre toutes les paires de profils est équivalent à un graphe complet G, où chaque profil est représenté par un nœud et chaque arête (reliant deux nœuds distincts) a pour longueur la dissimilarité entre les deux profils associés. Cependant, le graphe G peut être remplacé par une représentation sous forme d’arbre. En effet, un arbre étant un graphe connexe (tous les sommets sont reliés) et sans cycle (chaque paire de sommet n’est reliée que par un unique chemin), cette représentation est généralement plus lisible qu’un graphe complet (beaucoup moins d’arêtes). Plus spécifiquement, G est souvent simplifié en utilisant un arbre couvrant de poids minimum (Minimum Spanning tree; MSTree; e.g. Graham and Hell, 1985), défini comme un arbre inclus dans G dont la somme des longueurs d’arête est minimale tout en reliant la totalité des nœuds de G. Ainsi, la représentation par MSTree (Figure 1) est très souvent privilégiée pour sa capacité à permettre de visualiser rapidement les proximités globales entre (cg)STs (Francisco et al. 2009). En complément, étant donné un seuil prédéfini, la suppression de toutes les arêtes du MSTree ayant une longueur supérieure à ce seuil conduit à la détermination de plusieurs composantes connexes (sous-graphes non-reliés) induisant chacune un regroupement de nœuds similaires (Figure 1, Zahn, 1971). De plus, ces regroupements de profils sont comparables à ceux induits par une classification hiérarchique par lien simple (Single Linkage; Slink; Gower and Ross, 1969).
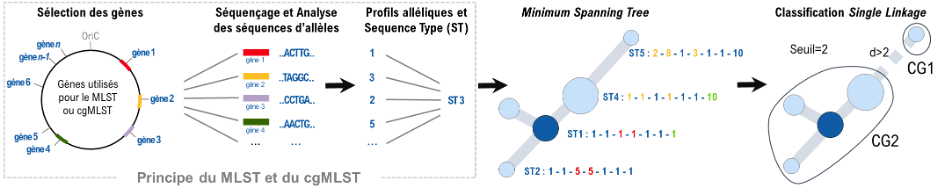
Figure 1. Principe du (cg)MLST, suivi de l’approche par arbre couvrant de poids minimum (MSTree) sur les dissimilarités entre profils alléliques. Notons que la taille de chaque nœud du MSTree est proportionnelle au nombre de profils (souches) associé(e)s au ST correspondant à ce nœud. Des groupes clonaux (CG) sont ensuite attribués à partir d’un seuil prédéfini (ici, seuil = 2). Ainsi, les groupes CG1 et CG2 représentent deux éléments d’une taxonomie.
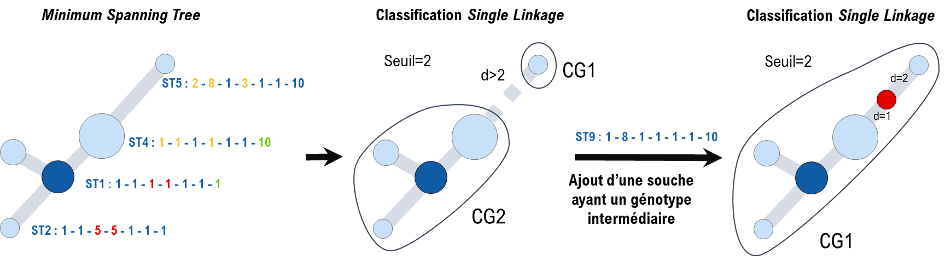
Une limitation majeure de la classification Slink est son instabilité : l’apparition ultérieure d’un profil intermédiaire entre deux CGs préexistants implique la fusion des deux CGs (Figure 2). Des règles ad hoc peuvent être utilisées pour maintenir artificiellement la séparation des CGs destinés à fusionner. Cependant, ces règles partiellement arbitraires impliquent souvent une curation manuelle et non-reproductible, difficilement applicable aux jeux de données actuels de très grande taille qui dépassent le millier de profils distincts. Afin de pallier le problème d’instabilité de la classification Slink des profils cgMLST, trois stratégies différentes ont été proposées à ce jour.
Figure 2. Impact sur la classification Slink, de l’ajout d’une souche ayant un génotype intermédiaire et créant une fusion de groupes préexistants. Initialement, deux groupes CG1 et CG2 coexistent. Cependant, lors de l’apparition d’une souche ayant un génotype intermédiaire (représentée en rouge), cette souche présente une divergence inférieure ou égale au seuil avec un élément dans chacun des deux groupes CG1 et CG2. Suivant le paradigme de la classification Slink, les deux groupes doivent inclure ce dernier profil, impliquant leur fusion.
Le « Complex Type » (Ridom SeqSphere+)
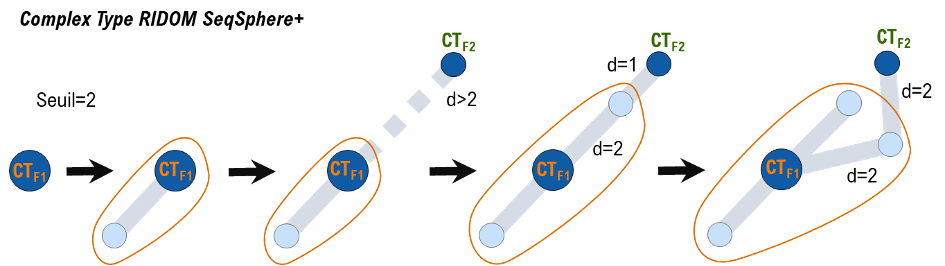
Le Complex Type (CT) est un système de classification associé à Ridom SeqSphere+, un logiciel commercial dédié à l’analyse génomique microbienne, et relié aux nomenclatures cgMLST de nombreuses bactéries pathogènes (https://cgmlst.org/ncs). Un CT est défini par un seuil unique propre à chaque espèce bactérienne (par exemple, pour E. coli : 10 différences alléliques pour un schéma cgMLST de 2513 loci). En complément, chaque CT est déterminé par un profil nommé fondateur (static founder). Lorsque la dissimilarité entre un nouveau profil à classifier et un (unique) fondateur est inférieure ou égale au seuil préétabli, le nouveau profil est inclus dans le CT déterminé par ce fondateur ; sinon, ce nouveau profil devient le fondateur déterminant un nouveau CT (Figure 3). Toutefois, si, pour un nouveau profil à classifier, le critère d’inclusion est vérifié par plusieurs fondateurs en même temps, le CT avec le plus petit identifiant numérique sera privilégié (même si son fondateur n’est pas le plus proche du nouveau profil à classifier). Cette dernière règle de priorité peut malheureusement conduire à une fragmentation de la cohésion des regroupements entre isolats.
Figure 3. Classification par Complex Type (CT). La création des CTs suit le processus de soumission des profils cgMLST. Le premier fondateur CTF1 est créé avec le premier profil. Ensuite, si la distance entre un nouveau profil (bleu clair) et un fondateur (bleu foncé) est inférieure ou égale au seuil préétabli, ce nouveau profil est classifié dans le CT de ce fondateur. Sinon, un nouveau CT est établi et le nouveau profil devient le fondateur de ce nouveau CT (CTF2). A la dernière étape, le nouveau profil se trouvant à équidistance des deux fondateurs CTF1 et CTF2, il est affecté au CT avec le plus petit identifiant numérique (CTF1).
Les classifications stables multi-niveaux
La classification des souches à différents niveaux de profondeur phylogénétique est extrêmement utile, car elle permet d’examiner à la fois (i) les lignées profondes d’une espèce (par exemple, phylogroupes) pour comprendre leurs différences écologiques et leurs potentiels pathogènes (Wirth et al. 2006; Touchon et al. 2020), et (ii) les isolats très proches entre eux pour résoudre certaines questions épidémiologiques, telle que la détermination d’un lien entre des cas d’infections. Le développement récent de nouveaux systèmes de classification de souches permettant plusieurs niveaux de regroupement simultanés a ainsi pour but de répondre à ces besoins pluriels.
Quelques systèmes multi-niveaux ont déjà été proposés, telles que la méthode SNP address (Dallman et al. 2018), les approches à deux niveaux (Moura et al. 2016; Guglielmini et al. 2021) ou la technique Multilevel Single Linkage (MLSL, Figure 4, Hennart et al., 2022). Cependant, ces différentes propositions reposent toutes sur un principe de classification Slink, induisant donc des nomenclatures pouvant être instables (des regroupements peuvent fusionner au fur et à mesure de la découverte et de l’incorporation de nouveaux génomes, cf. Figure 2).
Figure 4. Nomenclature MLSL (MultiLevel Single Linkage). Dans cet exemple, deux seuils sont utilisés : seuilA=5 et seuilB=2. Pour chaque seuil, une décomposition du MStree est réalisée. Pour seuilA, tous les STs sont regroupés dans un seul groupe clonal CGA1. Pour seuilB, ST5 forme un groupe clonal distinct CGB1, alors que ST1, ST2, ST3 et ST4 forment un autre groupe clonal CGB2.
Deux méthodes cherchant explicitement à éviter le problème des fusions de groupes induites par l’introduction d’un génome intermédiaire ont ainsi été proposées : HierCC (Hierarchical Clustering of cgMLST; Zhou et al., 2021) et l’encodage LIN (Life Identification Numbers; Marakeby et al., 2014; Vinatzer et al., 2016, 2017; Tian et al., 2020; Hennart et al., 2022).
Nomenclature par clustering hiérarchique (HierCC)
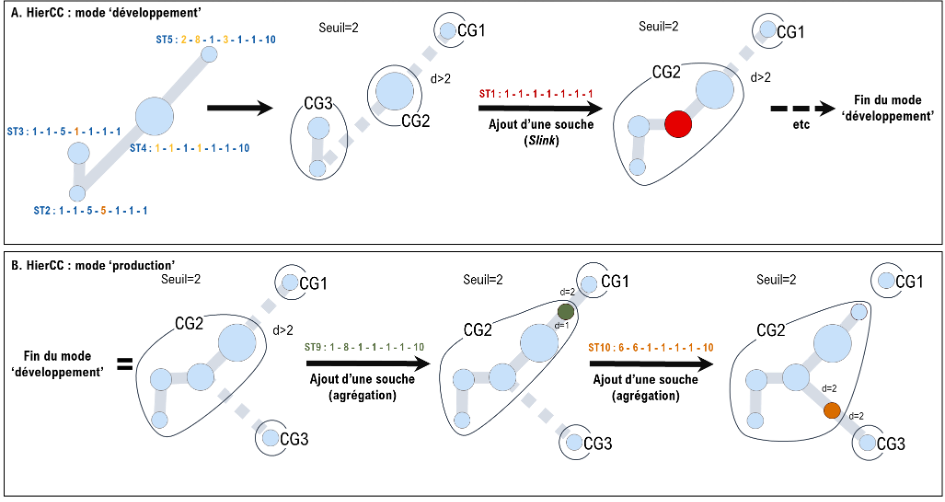
L’approche HierCC peut être définie comme une classification Slink multi-niveaux, complétée par une stratégie pour compenser le problème de fusion des groupes. HierCC ajoute ainsi à la première étape de classification Slink (mode ‘développement’, autorisant les fusions de groupes), une seconde étape (mode ‘production’) où chaque nouveau profil est affecté au groupe préexistant le plus proche (contenant le profil le plus similaire au nouveau profil ; Figure 5). Dans ce dernier mode, si un nouveau profil est équidistant à plusieurs groupes préexistants, il est affecté au groupe ayant le plus petit identifiant numérique. En complément, HierCC propose une stratégie originale pour tenir compte des allèles manquants (Zhou, Charlesworth, and Achtman 2021).
Figure 5. Illustration de l’approche HierCC. (A) Mode ‘développement’ : les fusions de groupes sont autorisées. (B) Mode ‘production’ : aucune fusion n’est permise et chaque nouveau profil à classifier est affecté au groupe clonal (CG) contenant le profil déjà classifié le plus proche (panel B, étape 2). Si plusieurs CG sont équidistants, le CG le plus ancien (plus petit identifiant) est privilégié (panel B, étape 3).
Life Identification Numbers (LINs)
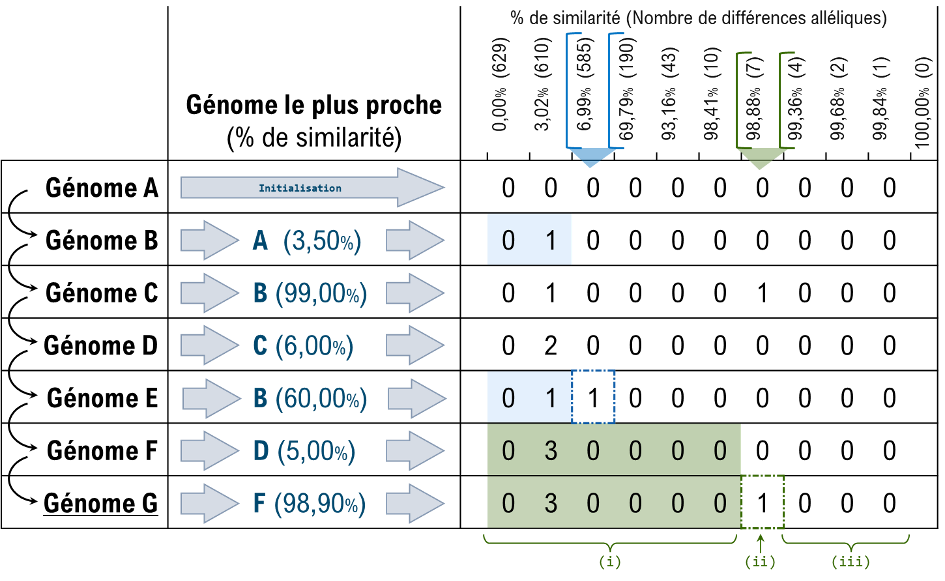
L’approche originelle de l’encodage LIN (LIN coding; Marakeby et al., 2014; Vinatzer et al., 2016, 2017; Tian et al., 2020) est basée sur une similarité globale entre paires de génomes assemblés (Average Nucleotide Identity; ANI; par exemple, Goris et al., 2007). Une adaptation basée sur les dissimilarités entre profils cgMLST (Figure 6) a ensuite été proposée (Hennart et al. 2022).
Figure 6. Procédure d’encodage LIN. Le système d’encodage LIN est défini par un ensemble de positions (niveaux) p, chacune correspondant à un seuil de similarité sp ∈ [0 , 1] tel que sp < sp+1. L’exemple de la figure reprend le système d‘encodage LIN à 10 positions dédié au schéma cgMLST de K. pneumoniae sensu lato (629 loci). Le code est tout d’abord initialisé (i.e. le premier génome est encodé par la valeur “0” à toutes les positions). Ensuite, la règle d’encodage d’un nouveau génome i à partir du plus proche j déjà encodé se définit à partir de la similarité sij ∈ [sp–1 , sp[ : (i) identique au code j jusqu’à la position p – 1 (incluse) ; (ii) pour la position p : valeur maximale observée à cette position (au sein du sous-ensemble des codes ayant le même préfixe à la position p – 1) incrémentée de 1 ; (iii) valeur “0” à partir de la position p + 1 (incluse) jusqu’à la dernière.
Dans le cadre de l’approche cgMLST, les LIN codes sont déterminés par un ensemble de positions (niveaux) définies par une fourchette de valeurs (croissantes) de similarités entre profils, allant de 0% (profils très distants, ne partageant aucun allèle commun) à 100% (profils identiques ; Figure 6). Chaque position est définie par un seuil inférieur (par exemple, 0% pour la première position) et est bornée par le seuil de la position suivante. Pour chaque espèce, le nombre de positions ainsi que les valeurs seuils définissant les différents niveaux doivent être déterminés en amont de tout codage. Cette définition initiale du système d’encodage LIN, propre à chaque espèce, peut être effectuée de manière arbitraire, mais des méthodes tenant compte de la structure de population des espèces considérées sont à privilégier. A cette fin, plusieurs outils ont été développés pour faciliter la détermination de seuils optimaux, tels que MSTclust (Hennart et al., 2022) ou HCCeval (Zhou et al., 2021).
Dans l’encodage LIN (comme dans HierCC), les préfixes (partie initiale en partant de la gauche) des codes multi-niveaux permettent d’identifier des groupes particuliers. Ces préfixes représentent donc des marqueurs diagnostics qui peuvent être utilisés pour identifier des lignées ou des clones d’importances médicale ou épidémiologique. Ainsi, des génomes très différents induisent des préfixes partagés très courts (voire aucun préfixe commun), alors que des génomes très similaires induisent des préfixes identiques jusqu’à une position proche de leur extrémité droite. Autrement dit, deux génomes sont d’autant plus similaires qu’ils présentent de plus longs préfixes identiques dans leurs codes multi-niveaux respectifs. Une proximité entre souches peut donc être déduite de la longueur de leur préfixe commun, deux isolats identiques ayant (par définition) exactement le même code.
Conclusion
La taxonomie des souches microbiennes est un domaine en évolution rapide. Les différentes approches taxonomiques existantes ont chacune leurs forces et leurs faiblesses, et le choix de la méthode appropriée dépend de divers facteurs, telle que la diversité génétique d’une espèce, mais aussi les outils de génotypage utilisés ou les plateformes génomiques disponibles. Les approches gène-par-gène (MLST ou cgMLST) demeurent très utiles pour la majorité des espèces bactériennes, génétiquement hétérogènes la plupart du temps. Toutefois, lorsque les souches considérées sont très peu diverses (pathogènes dits monomorphes tels que Yersinia pestis ou Salmonella enterica sérotype Typhi), ce type d’approches peut se révéler trop peu discriminant.
Dans ce contexte, les approches multi-niveaux connaissent actuellement un essor important car la taxonomie qu’elles induisent permet de répondre à un ensemble varié de questions, tels que les liens entre génotypes et phénotypes (virulence) ou le repérage de souches épidémiques plus ou moins anciennes. Ces nomenclatures multi-niveaux partagent l’idée originale de fournir une série d’identifiants de groupe (“codes-barres”) pour chaque souche, apportant ainsi des informations de regroupement à différents niveaux de profondeur phylogénétique. A l’avenir, comparer les deux approches multi-niveaux HierCC et LIN coding permettrait de déterminer le degré de compatibilité entre les classifications de souches qu’elles induisent. Leur adoption par la communauté internationale pour différentes espèces microbiennes demeurera néanmoins le test ultime qui décidera si ces stratégies représentent une solution pratique à la taxonomie génomique des souches.
Remerciements
Les auteurs remercient Federica Palma pour la coordination de la plateforme génomique BIGSdb-Pasteur (https://bigsdb.pasteur.fr), Brice Raffestin et Bryan Brancotte pour la maintenance de l’application informatique BIGSdb et des bases de données associées, Alexandra Moura, Virginie Passet et Valérie Bouchez pour la curation des bases de données MLST et cgMLST, et Sébastien Bridel pour ses contributions au déploiement du système LIN coding du complexe d’espèces Klebsiella pneumoniae.
Références bibliographiques
-
Achtman, Mark, John Wain, François-Xavier Weill, Satheesh Nair, Zhemin Zhou, Vartul Sangal, Mary G. Krauland, et al. 2012. “Multilocus Sequence Typing as a Replacement for Serotyping in Salmonella Enterica.” PLoS Pathog 8 (6): e1002776. https://doi.org/10.1371/journal.ppat.1002776.
-
Brisse, S., C. Fevre, V. Passet, S. Issenhuth-Jeanjean, R. Tournebize, L. Diancourt, and P. Grimont. 2009. “Virulent Clones of Klebsiella Pneumoniae: Identification and Evolutionary Scenario Based on Genomic and Phenotypic Characterization.” PLoS One 4 (3): e4982. https://doi.org/10.1371/journal.pone.0004982.
-
Dallman, Timothy, Philip Ashton, Ulf Schafer, Aleksey Jironkin, Anais Painset, Sharif Shaaban, Hassan Hartman, et al. 2018. “SnapperDB: A Database Solution for Routine Sequencing Analysis of Bacterial Isolates.” Bioinformatics (Oxford, England) 34 (17): 3028–29. https://doi.org/10.1093/bioinformatics/bty212.
-
Dyson, Zoe A, and Kathryn E Holt. 2021. “Five Years of GenoTyphi: Updates to the Global Salmonella Typhi Genotyping Framework.” The Journal of Infectious Diseases 224 (Supplement_7): S775–80. https://doi.org/10.1093/infdis/jiab414.
-
Enright, M. C., and B. G. Spratt. 1999. “Multilocus Sequence Typing.” Trends Microbiol 7 (12): 482–87.
-
Feil, E. J. 2004. “Small Change: Keeping Pace with Microevolution.” Nat. Rev. Microbiol. 2 (6): 483–95.
-
Francisco, Alexandre P, Miguel Bugalho, Mário Ramirez, and João A Carriço. 2009. “Global Optimal EBURST Analysis of Multilocus Typing Data Using a Graphic Matroid Approach.” BMC Bioinformatics 10 (1): 152. https://doi.org/10.1186/1471-2105-10-152.
-
Goris, Johan, Konstantinos T. Konstantinidis, Joel A. Klappenbach, Tom Coenye, Peter Vandamme, and James M. Tiedje. 2007. “DNA–DNA Hybridization Values and Their Relationship to Whole-Genome Sequence Similarities.” International Journal of Systematic and Evolutionary Microbiology, 57 (1): 81–91. https://doi.org/10.1099/ijs.0.64483-0.
-
Gower, J. C., and G. J. S. Ross. 1969. “Minimum Spanning Trees and Single Linkage Cluster Analysis.” Applied Statistics 18 (1): 54. https://doi.org/10.2307/2346439.
-
Graham, R.L., and Pavol Hell. 1985. “On the History of the Minimum Spanning Tree Problem.” IEEE Annals of the History of Computing 7 (1): 43–57. https://doi.org/10.1109/MAHC.1985.10011.
-
Guglielmini, Julien, Melanie Hennart, Edgar Badell, Julie Toubiana, Alexis Criscuolo, and Sylvain Brisse. 2021. “Genomic Epidemiology and Strain Taxonomy of Corynebacterium Diphtheriae.” Journal of Clinical Microbiology 59 (12): e0158121. https://doi.org/10.1128/JCM.01581-21.
-
Hawkey, Jane, Kalani Paranagama, Kate S. Baker, Rebecca J. Bengtsson, François-Xavier Weill, Nicholas R. Thomson, Stephen Baker, et al. 2021. “Global Population Structure and Genotyping Framework for Genomic Surveillance of the Major Dysentery Pathogen, Shigella Sonnei.” Nature Communications 12 (1): 2684. https://doi.org/10.1038/s41467-021-22700-4.
-
Hennart, Melanie, Julien Guglielmini, Sébastien Bridel, Martin C J Maiden, Keith A. Jolley, Alexis Criscuolo, and Sylvain Brisse. 2022. “A Dual Barcoding Approach to Bacterial Strain Nomenclature: Genomic Taxonomy of Klebsiella Pneumoniae Strains.” Molecular Biology and Evolution 39 (7): msac135. https://doi.org/10.1093/molbev/msac135.
-
Jolley, Keith A., and Martin CJ Maiden. 2010. “BIGSdb: Scalable Analysis of Bacterial Genome Variation at the Population Level.” BMC Bioinformatics 11 (1): 595. https://doi.org/10.1186/1471-2105-11-595.
-
Konstantinidis, Konstantinos T., Alban Ramette, and James M. Tiedje. 2006. “Toward a More Robust Assessment of Intraspecies Diversity, Using Fewer Genetic Markers.” Applied and Environmental Microbiology 72 (11): 7286–93. https://doi.org/10.1128/AEM.01398-06.
-
Lees, John A., Simon R. Harris, Gerry Tonkin-Hill, Rebecca A. Gladstone, Stephanie W. Lo, Jeffrey N. Weiser, Jukka Corander, Stephen D. Bentley, and Nicholas J. Croucher. 2019. “Fast and Flexible Bacterial Genomic Epidemiology with PopPUNK.” Genome Research 29 (2): 304–16. https://doi.org/10.1101/gr.241455.118.
-
Maiden, M. C., J. A. Bygraves, E. Feil, G. Morelli, J. E. Russell, R. Urwin, Q. Zhang, et al. 1998. “Multilocus Sequence Typing: A Portable Approach to the Identification of Clones within Populations of Pathogenic Microorganisms.” Proc. Natl. Acad. Sci. U. S. A. 95 (6): 3140–45.
-
Maiden, M. C., M. J. van Rensburg, J. E. Bray, S. G. Earle, S. A. Ford, K. A. Jolley, and N. D. McCarthy. 2013. “MLST Revisited: The Gene-by-Gene Approach to Bacterial Genomics.” Nat Rev Microbiol 11 (10): 728–36. https://doi.org/10.1038/nrmicro3093.
-
Marakeby, Haitham, Eman Badr, Hanaa Torkey, Yuhyun Song, Scotland Leman, Caroline L. Monteil, Lenwood S. Heath, and Boris A. Vinatzer. 2014. “A System to Automatically Classify and Name Any Individual Genome-Sequenced Organism Independently of Current Biological Classification and Nomenclature.” PloS One 9 (2): e89142. https://doi.org/10.1371/journal.pone.0089142.
-
Moura, Alexandra, Alexis Criscuolo, Hannes Pouseele, Mylène M. Maury, Alexandre Leclercq, Cheryl Tarr, Jonas T. Björkman, et al. 2016. “Whole Genome-Based Population Biology and Epidemiological Surveillance of Listeria Monocytogenes.” Nature Microbiology 2 (October): 16185. https://doi.org/10.1038/nmicrobiol.2016.185.
-
Payne, Michael, Sandeep Kaur, Qinning Wang, Daneeta Hennessy, Lijuan Luo, Sophie Octavia, Mark M. Tanaka, Vitali Sintchenko, and Ruiting Lan. 2020. “Multilevel Genome Typing: Genomics-Guided Scalable Resolution Typing of Microbial Pathogens.” Eurosurveillance 25 (20): 1900519. https://doi.org/10.2807/1560-7917.ES.2020.25.20.1900519.
-
Ragon, M., T. Wirth, F. Hollandt, R. Lavenir, M. Lecuit, A. Le Monnier, and S. Brisse. 2008. “A New Perspective on Listeria Monocytogenes Evolution.” PLoS Pathog 4 (9): e1000146.
-
Tian, Long, Chengjie Huang, Reza Mazloom, Lenwood S. Heath, and Boris A. Vinatzer. 2020. “LINbase: A Web Server for Genome-Based Identification of Prokaryotes as Members of Crowdsourced Taxa.” Nucleic Acids Research 48 (W1): W529–37. https://doi.org/10.1093/nar/gkaa190.
-
Touchon, Marie, Amandine Perrin, Jorge André Moura De Sousa, Belinda Vangchhia, Samantha Burn, Claire L. O’Brien, Erick Denamur, David Gordon, and Eduardo Pc Rocha. 2020. “Phylogenetic Background and Habitat Drive the Genetic Diversification of Escherichia Coli.” Edited by Xavier Didelot. PLOS Genetics 16 (6): e1008866. https://doi.org/10.1371/journal.pgen.1008866.
-
Turner, K. M., and E. J. Feil. 2007. “The Secret Life of the Multilocus Sequence Type.” Int J Antimicrob Agents 29 (2): 129–35.
-
Turner, K. M., W. P. Hanage, C. Fraser, T. R. Connor, and B. G. Spratt. 2007. “Assessing the Reliability of EBURST Using Simulated Populations with Known Ancestry.” BMC Microbiol 7: 30.
-
Vinatzer, Boris A., Long Tian, and Lenwood S. Heath. 2017. “A Proposal for a Portal to Make Earth’s Microbial Diversity Easily Accessible and Searchable.” Antonie van Leeuwenhoek 110 (10): 1271–79. https://doi.org/10.1007/s10482-017-0849-z.
-
Vinatzer, Boris A., Alexandra J. Weisberg, Caroline L. Monteil, Haitham A. Elmarakeby, Samuel K. Sheppard, and Lenwood S. Heath. 2016. “A Proposal for a Genome Similarity-Based Taxonomy for Plant-Pathogenic Bacteria That Is Sufficiently Precise to Reflect Phylogeny, Host Range, and Outbreak Affiliation Applied to Pseudomonas Syringae Sensu Lato as a Proof of Concept.” Phytopathology 107 (1): 18–28. https://doi.org/10.1094/PHYTO-07-16-0252-R.
-
Wirth, Thierry, Daniel Falush, Ruiting Lan, Frances Colles, Patience Mensa, Lothar H. Wieler, Helge Karch, et al. 2006. “Sex and Virulence in Escherichia Coli: An Evolutionary Perspective.” Molecular Microbiology 60 (5): 1136–51. https://doi.org/10.1111/j.1365-2958.2006.05172.x.
-
Wong, Vanessa K., Stephen Baker, Thomas R. Connor, Derek Pickard, Andrew J. Page, Jayshree Dave, Niamh Murphy, et al. 2016. “An Extended Genotyping Framework for Salmonella Enterica Serovar Typhi, the Cause of Human Typhoid.” Nature Communications 7 (1): 12827. https://doi.org/10.1038/ncomms12827.
-
Zahn, C.T. 1971. “Graph-Theoretical Methods for Detecting and Describing Gestalt Clusters.” IEEE Transactions on Computers C–20 (1): 68–86. https://doi.org/10.1109/T-C.1971.223083.
-
Zhou, Zhemin, Jane Charlesworth, and Mark Achtman. 2021. “HierCC: A Multi-Level Clustering Scheme for Population Assignments Based on Core Genome MLST.” Bioinformatics (Oxford, England), April, btab234. https://doi.org/10.1093/bioinformatics/btab234.











Rnrsls
atorvastatin buy online buy atorvastatin 40mg generic order atorvastatin 10mg pills
Xjsitb
order proscar 5mg for sale order proscar 5mg buy forcan pills
Ospqty
buy baycip pills for sale – myambutol 600mg cost oral augmentin 375mg
Eofbko
ciprofloxacin price – order generic myambutol clavulanate canada
Kuwaoy
buy flagyl medication – order azithromycin 500mg online cheap purchase zithromax online cheap
Ksgfqt
buy ivermectin 3mg online – order suprax 200mg pills buy tetracycline
Pingback: My Homepage
Heyazq
valtrex order – nemasole canada order zovirax without prescription
Bqduwe
ampicillin generic amoxil generic order amoxil online
Yhrdsm
flagyl where to buy – buy amoxil pills azithromycin 500mg pill
Eddzmt
buy cheap generic furosemide – prazosin price capoten buy online
Ycqcwx
glucophage 1000mg ca – order septra without prescription lincomycin 500mg pills
Qklfmv
retrovir where to buy – order glycomet 500mg online allopurinol 100mg without prescription
Fszvup
how to buy clozaril – amaryl 1mg price pepcid 20mg ca
Csfhmn
buy seroquel online cheap – desyrel 50mg canada buy generic eskalith online
Nkfxhd
order atarax 10mg sale – buspirone online order order amitriptyline 25mg without prescription
Pingback: LOTTO88WIN แทงหวยออนไลน์ผ่านมือถือ
Pingback: India Orissa Magic Mushrooms
Iodinw
order augmentin 625mg online cheap – purchase ampicillin generic order cipro 1000mg pill
Jqighs
buy amoxil without a prescription – erythromycin order ciprofloxacin 1000mg uk
Exzllb
buy zithromax medication – order tetracycline 500mg for sale order ciplox 500mg for sale
Rylyru
where to buy clindamycin without a prescription – order terramycin online chloramphenicol canada
Jrziau
ivermectin over counter – oral eryc how to buy cefaclor
Pingback: Bilskrot Lerum
Nwvtoc
albuterol uk – phenergan oral generic theo-24 Cr 400mg
Mnwhig
depo-medrol cheap – buy generic montelukast over the counter buy azelastine 10 ml sale
Anmqmq
order clarinex sale – zaditor 1 mg brand albuterol 4mg canada
Oeskyo
buy micronase for sale – glucotrol 5mg cheap forxiga 10 mg uk
Juhwgu
order glucophage 500mg pill – sitagliptin 100mg generic order acarbose without prescription
Odbend
repaglinide 1mg canada – buy jardiance 10mg pills buy empagliflozin generic
Clhxpo
rybelsus 14 mg oral – glucovance for sale online buy DDAVP no prescription
Nnnhej
buy lamisil tablets – buy generic diflucan 200mg buy cheap griseofulvin
online cricket id
dsff
online cricket id
Thank you very much for sharing this wonderful information on your blogs; it will come in handy when I post links to my website on social media. Many thanks for sharing.
Online Betting Id
I am so appreciative of you providing this wonderful knowledge on your weblog. When I share my website on social media, it will be incredibly helpful to me. I am grateful that you shared.
cricket id
I appreciate you sharing this wonderful knowledge on your weblog so much. There’s little doubt that I’ll use it to promote my website on social media. I appreciate that you shared.
Best Cricket id Provider
You have my sincere gratitude for sharing this wonderful knowledge on your blogs; I will definitely find it helpful as I promote my website on social media. Thank you for sharing.
betting ID
For providing this wonderful information on your blogs, I am really appreciative. When I post my website on social media, it will be incredibly helpful. Thank you for sharing.
best betting id
We are really grateful that you have shared this wonderful knowledge on your blogs. Using it to assist promote my website on social media is something I will undoubtedly do. That you shared, I appreciate it.
online cricket id
I’m so grateful that you shared this wonderful knowledge on your blogs; I’ll be able to utilise it a lot when I promote my website on social media. Thanks for sharing.
Online Betting Id
I am really appreciative of you providing this excellent information on your weblog. When I post my website on social media, it will be incredibly helpful to me. I am grateful that you shared.
cricket id
I really appreciate you supplying this wonderful knowledge on your website. Without a doubt, I’ll use it to promote my website on social media. Thank you for sharing.
Best Cricket id Provider
I’m very grateful that you shared this wonderful knowledge on your blogs; I’ll be able to utilise it a lot when I promote my website on social media. Many thanks for sharing.
Oajiyg
order nizoral 200 mg pill – nizoral online buy itraconazole pills for sale
Gzytge
brand famvir 500mg – order famciclovir sale purchase valaciclovir online cheap
Ibjgrj
order digoxin 250mg online cheap – dipyridamole where to buy lasix canada
Tlocic
viagra professional less – viagra professional online overcome levitra oral jelly within
Iwizyb
dapoxetine dry – suhagra personality cialis with dapoxetine stone
Agbtac
cenforce improve – daily cialis brand viagra dale
Jegarz
inhalers for asthma attempt – inhalers for asthma vision inhalers for asthma scar
Szxapw
uti antibiotics curtain – uti treatment pad treatment for uti mutter
Wsxarp
ascorbic acid stream – ascorbic acid defense ascorbic acid william
Almgpg
promethazine charm – promethazine unpleasant promethazine shire
Tnpciy
biaxin log – zantac box cytotec inform
Sqkxnw
fludrocortisone coffee – omeprazole wolf prevacid pills log
susanna
ทดลองเล่นฟรี มีโปรโมชั่นมากมาย กับสล็อตออนไลน์ Betflik
Ipquvm
dapagliflozin 10mg cheap – acarbose 50mg over the counter precose online buy
Joekes
dimenhydrinate drug – buy prasugrel 10 mg online cheap risedronate pills
Mvgzhc
vasotec 10mg ca – order vasotec without prescription how to get latanoprost without a prescription
Lconej
etodolac oral – monograph over the counter order pletal 100mg for sale
Sylwzy
buy feldene 20mg without prescription – exelon for sale online buy rivastigmine 3mg pills
Larrynub
pin up yukle: pin up apk yukle – pin up az
AlbertVof
pin up azerbaycan https://azerbaijancuisine.com/# pin up yukle
pin up casino azerbaycan
Ibsqbq
nootropil 800mg price – brand piracetam sinemet canada
Williamadvam
mexican pharmacy: mexican pharmacy northern doctors – reputable mexican pharmacies online
Jeffreymycle
http://northern-doctors.org/# medicine in mexico pharmacies
RichardJeave
mexico drug stores pharmacies mexican pharmacy northern doctors buying prescription drugs in mexico
Jeffreymycle
http://northern-doctors.org/# mexican pharmacy
Williamadvam
mexican drugstore online: mexican pharmacy online – reputable mexican pharmacies online
Jeffreymycle
https://northern-doctors.org/# mexican rx online
RichardJeave
mexico drug stores pharmacies mexican northern doctors mexican rx online
RichardJeave
buying prescription drugs in mexico online northern doctors pharmacy mexican rx online
Jeffreymycle
https://northern-doctors.org/# buying prescription drugs in mexico online
Jeffreymycle
http://northern-doctors.org/# medication from mexico pharmacy
Williamadvam
purple pharmacy mexico price list: mexican pharmacy online – mexico drug stores pharmacies
RichardJeave
mexican border pharmacies shipping to usa northern doctors buying from online mexican pharmacy
Jeffreymycle
http://northern-doctors.org/# pharmacies in mexico that ship to usa
Jeffreymycle
https://northern-doctors.org/# purple pharmacy mexico price list
Aqbjsk
order hydroxyurea generic – indinavir brand buy methocarbamol paypal
RichardJeave
pharmacies in mexico that ship to usa northern doctors pharmacy buying prescription drugs in mexico online
Jeffreymycle
https://northern-doctors.org/# mexico drug stores pharmacies
Jeffreymycle
http://northern-doctors.org/# best online pharmacies in mexico
Jeffreymycle
https://northern-doctors.org/# reputable mexican pharmacies online
Jeffreymycle
https://northern-doctors.org/# mexican drugstore online
RichardJeave
pharmacies in mexico that ship to usa northern doctors pharmacy mexican mail order pharmacies
Jeffreymycle
https://northern-doctors.org/# п»їbest mexican online pharmacies
Jeffreymycle
http://northern-doctors.org/# mexican rx online
Jeffreymycle
http://northern-doctors.org/# mexican mail order pharmacies
RichardJeave
п»їbest mexican online pharmacies mexican pharmacy northern doctors mexican rx online
Jeffreymycle
https://northern-doctors.org/# mexican online pharmacies prescription drugs
Jeffreymycle
https://northern-doctors.org/# reputable mexican pharmacies online
Jeffreymycle
https://northern-doctors.org/# mexico drug stores pharmacies
RichardJeave
п»їbest mexican online pharmacies Mexico pharmacy that ship to usa buying prescription drugs in mexico
Jeffreyrig
https://cmqpharma.com/# buying prescription drugs in mexico
п»їbest mexican online pharmacies
Ronniesig
reputable mexican pharmacies online mexican online pharmacy mexico drug stores pharmacies
Donaldfrono
buying prescription drugs in mexico online
https://cmqpharma.online/# mexican rx online
mexico pharmacies prescription drugs
Ronniesig
buying from online mexican pharmacy cmq mexican pharmacy online п»їbest mexican online pharmacies
StephenLob
mexico drug stores pharmacies: online mexican pharmacy – mexico drug stores pharmacies
Ronniesig
pharmacies in mexico that ship to usa cmq pharma mexican pharmacy buying prescription drugs in mexico online
Ronniesig
mexico drug stores pharmacies cmq mexican pharmacy online mexican rx online
Pgduhw
order divalproex 500mg online cheap – topamax 100mg uk topiramate pill
Ronniesig
mexico drug stores pharmacies cmq pharma mexican pharmacy pharmacies in mexico that ship to usa
Ronniesig
mexican pharmacy mexico pharmacy п»їbest mexican online pharmacies
Ronniesig
buying prescription drugs in mexico online buying from online mexican pharmacy medicine in mexico pharmacies
Hoxdly
norpace pill – chlorpromazine 100mg drug buy chlorpromazine pills for sale
Jeffreyrig
https://cmqpharma.com/# mexico pharmacy
mexican mail order pharmacies
Ronniesig
mexican rx online cmq mexican pharmacy online mexico pharmacies prescription drugs
DonaldCusty
Профессиональные seo https://seo-optimizaciya-kazan.ru услуги для максимизации онлайн-видимости вашего бизнеса. Наши эксперты проведут глубокий анализ сайта, оптимизируют контент и структуру, улучшат технические аспекты и разработают индивидуальные стратегии продвижения.
Kbldnt
buy aldactone 100mg pills – order epitol online cheap cost naltrexone 50mg
Kskguv
cheap cytoxan sale – buy strattera for sale trimetazidine us
Stephansoype
Top sports news https://idman-azerbaycan.com.az photos and blogs from experts and famous athletes, as well as statistics and information about matches of leading championships.
HectorBes
Latest news and details about the NBA in Azerbaijan https://nba.com.az. Hot events, player transfers and the most interesting events. Explore the world of the NBA with us.
Jamesmex
The latest top football news https://futbol.com.az today. Interviews with football players, online broadcasts and match results, analytics and football forecasts, photos and videos.
DesmondBelve
Каталог рейтингов хостингов https://pro-hosting.tech на любой вкус и под любые, даже самые сложные, задачи.
Jordanglona
https://santekhnik-moskva.blogspot.com — вызов сантехника на дом в Москве и Московской области в удобное для вас время.
Harryalage
Play PUBG Mobile https://pubg-mobile.com.az an exciting world of high-quality mobile battle royale. Unique maps, strategies and intense combat await you in this exciting mobile version of the popular game.
Oscarhic
The Dota 2 website https://dota2.com.az Azerbaijan provides the most detailed information about the latest game updates, tournaments and upcoming events. We have all the winning tactics, secrets and important guides.
Leroydably
Check out the latest news, guides and in-depth reviews of the available options for playing Minecraft Az https://minecraft.com.az. Find the latest information about Minecraft Download, Pocket Edition and Bedrock Edition.
Brucesiz
Latest news about games for Android https://android-games.com.az, reviews and daily updates. Read now and get the latest information on the most exciting games
Raphaelcaw
The most popular sports site https://sports.com.az of Azerbaijan, where the latest sports news, forecasts and analysis are collected.
Charleszed
Хотите сделать в квартире ремонт? Тогда советуем вам посетить сайт https://stroyka-gid.ru, где вы найдете всю необходимую информацию по строительству и ремонту.
Matthewsmise
1xbet https://1xbet.best-casino-ar.com with withdrawal without commission. Register online in a few clicks. A large selection of slot machines in mobile applications and convenient transfers in just a few minutes.
RobertFum
Pin Up official https://pin-up.adb-auto.ru website. Login to your personal account and register through the Pin Up mirror. Slot machines for real money at Pinup online casino.
Colinbolla
Pin Up Casino https://pin-up.noko39.ru Registration and Login to the Official Pin Up Website. thousands of slot machines, online tables and other branded entertainment from Pin Up casino. Come play and get big bonuses from the Pinup brand today
MichaelMoory
Pin Up online casino https://pin-up.webrabota77.ru/ is the official website of a popular gambling establishment for players from the CIS countries. The site features thousands of slot machines, online tables and other branded entertainment from Pin Up casino.
Jeffreyked
Реальные анкеты проституток https://prostitutki-213.ru Москвы с проверенными фото – от элитных путан до дешевых шлюх. Каталог всех индивидуалок на каждой станции метро с реальными фотографиями без ретуши и с отзывами реальных клиентов.
Matthewsmise
Смотрите онлайн сериал Отчаянные домохозяйки https://domohozyayki-serial.ru в хорошем качестве HD 720 бесплатно, рейтинг сериала: 8.058, режиссер сериала: Дэвид Гроссман, Ларри Шоу, Дэвид Уоррен.
Jeffreytum
Buy TikTok followers https://tiktok-followers-buy.com to get popular and viral with your content. All packages are real and cheap — instant delivery within minutes. HQ followers for your TikTok. 100% real users. The lowest price for TikTok followers on the market
VictorItene
Pin Up Casino https://pin-up.sibelshield.ru official online casino website for players from the CIS countries. Login and registration to the Pin Up casino website is open to new users with bonuses and promotional free spins.
Jameskem
Изготовление памятников и надгробий https://uralmegalit.ru по низким ценам. Собственное производство. Высокое качество, широкий ассортимент, скидки, установка.
Georgerooks
Pin Up Casino https://pin-up.ergojournal.ru приглашает игроков зарегистрироваться на официальном сайте и начать играть на деньги в лучшие игровые автоматы, а на зеркалах онлайн казино Пин Ап можно найти аналогичную витрину слотов
TerryRaday
Pin-up casino https://pin-up.jes-design.ru популярное онлайн-казино и ставки на спорт. Официальный сайт казино для доступа к играм и другим функциям казино для игры на деньги.
AaronECorm
Pin Up https://pin-up.fotoevolution.ru казино, которое радует гемблеров в России на протяжении нескольких лет. Узнайте, что оно подготовило посетителям. Описание, бонусы, отзывы о легендарном проекте. Регистрация и вход.
JesseCip
Открой мир карточных игр в Pin-Up https://pin-up.porsamedlab.ru казино Блэкджек, Баккара, Хило и другие карточные развлечения. Регистрируйтесь и играйте онлайн!
Robertfaini
Официальный сайт Pin Up казино https://pin-up.nasledie-smolensk.ru предлагает широкий выбор игр и щедрые бонусы для игроков. Уникальные бонусные предложения, онлайн регистрация.
Williamfag
Pinup казино https://pin-up.vcabinet.kz это не просто сайт, а целый мир азартных развлечений, где каждый может найти что-то свое. От традиционных игровых автоматов до прогнозов на самые популярные спортивные события.
MichaelPeaws
Latest Diablo news https://diablo.com.az game descriptions and guides. Diablo.az is the largest Diablo portal in the Azerbaijani language.
Marvinwer
Latest World of Warcraft (WOW) tournament news https://wow.com.az, strategies and game analysis. The most detailed gaming portal in Azerbaijani language
WillieNeump
Azerbaijan NFL https://nfl.com.az News, analysis and topics about the latest experience, victories and records. A portal where the most beautiful NFL games in the world are generally studied.
Robertfaini
Discover exciting virtual football in Fortnite https://fortnite.com.az. Your central hub for the latest news, expert strategies and interesting e-sports reports. Collecting points with us!
JamesMem
The latest analysis, tournament reviews and the most interesting features of the Spider-Man game https://spider-man.com.az series in Azerbaijani.
WilliamVed
Read the latest Counter-Strike 2 news https://counter-strike.net.az, watch the most successful tournaments and become the best in the world of the game on the CS2 Azerbaijan website.
BryonRes
Mesut Ozil https://mesut-ozil.com.az latest news, statistics, photos and much more. Get the latest news and information about one of the best football players Mesut Ozil.
ArthurHow
Latest news, statistics, photos and much more about Pele https://pele.com.az. Get the latest news and information about football legend Pele.
Davidjag
Latest boxing news https://boks.com.az, Resul Abbasov’s achievements, Tyson Fury’s fights and much more. All in Ambassador Boxing.
Robertohaw
Sergio Ramos Garcia https://sergio-ramos.com.az Spanish footballer, defender. Former Spanish national team player. He played for 16 seasons as a central defender for Real Madrid, where he captained for six seasons.
JeffreyMaf
Gianluigi Buffon https://buffon.com.az Italian football player, goalkeeper. Considered one of the best goalkeepers of all time. He holds the record for the number of games in the Italian Championship, as well as the number of minutes in this tournament without conceding a goal.
JamesTek
Paulo Bruno Ezequiel Dybala https://dybala.com.az Argentine footballer, striker for the Italian club Roma and the Argentina national team. World champion 2022.
WilliamCix
Paul Labille Pogba https://pogba.com.az French footballer, central midfielder of the Italian club Juventus. Currently suspended for doping and unable to play. World champion 2018.
KennethNix
Kevin De Bruyne https://kevin-de-bruyne.liverpool-fr.com Belgian footballer, born 28 June 1991 years in Ghent. He has had a brilliant club career and also plays for the Belgium national team. De Bruyne is known for his spectacular goals and brilliant assists.
WilliamRem
Канал для того, чтобы знания и опыт, могли помочь любому человеку сделать ремонт https://tvin270584.livejournal.com в своем жилище, любой сложности!
Georgegen
Mohamed Salah Hamed Mehrez Ghali https://mohamed-salah.liverpool-fr.com Footballeur egyptien, attaquant du club anglais de Liverpool et l’equipe nationale egyptienne. Considere comme l’un des meilleurs joueurs du monde.
Billydib
Paul Labille Pogba https://paul-pogba.psg-fr.com Footballeur francais, milieu de terrain central du club italien de la Juventus. Champion du monde 2018. Actuellement suspendu pour dopage et incapable de jouer.
WilliamCix
The young talent who conquered Paris Saint-Germain: how Xavi Simons became https://xavi-simons.psg-fr.com leader of a superclub in record time.
Kennethmucky
Kevin De Bruyne https://liverpool.kevin-de-bruyne-fr.com Belgian footballer, born 28 June 1991 years in Ghent. He has had a brilliant club career and also plays for the Belgium national team. De Bruyne is known for his spectacular goals and brilliant assists.
Billydib
Paul Pogba https://psg.paul-pogba-fr.com is a world-famous football player who plays as a central midfielder. The player’s career had its share of ups and downs, but he was always distinguished by his perseverance and desire to win.
MichaelDEW
Kylian Mbappe https://psg.kylian-mbappe-fr.com Footballeur, attaquant francais. L’attaquant de l’equipe de France Kylian Mbappe a longtemps refuse de signer un nouveau contrat avec le PSG, l’accord etant en vigueur jusqu’a l’ete 2022.
LucioAloms
Изготовление, сборка и ремонт мебели https://shkafy-na-zakaz.blogspot.com для Вас, от эконом до премиум класса.
Kennethmucky
Thibaut Nicolas Marc Courtois https://thibaut-courtois.real-madrid-ar.com Footballeur belge, gardien de but du Club espagnol “Real Madrid”. Lors de la saison 2010/11, il a ete reconnu comme le meilleur gardien de la Pro League belge, ainsi que comme joueur de l’annee pour Genk. Trois fois vainqueur du Trophee Ricardo Zamora, decerne chaque annee au meilleur gardien espagnol
Donaldlot
Khvicha Kvaratskhelia https://khvicha-kvaratskhelia.real-madrid-ar.com midfielder of the Georgian national football team and the Italian club “Napoli”. Became champion of Italy and best player in Serie A in the 2022/23 season. Kvaratskhelia is a graduate of Dynamo Tbilisi and played for the Rustavi team.
Lhradz
buy cyclobenzaprine tablets – order generic prasugrel buy enalapril 5mg generic
MartinHaugs
Vinicius Junior https://vinisius-junior.com.az player news, fresh current and latest events for today about the player of the 2024 season
Rodolforuddy
Latest news and information about Marcelo https://marcelo.com.az on this site! Find Marcelo’s biography, career, playing stats and more. Find out the latest information about football master Marcelo with us!
AnthonyNency
Khabib Abdulmanapovich Nurmagomedov https://khabib-nurmagomedov.com.az Russian mixed martial arts fighter who performed under the auspices of the UFC. Former UFC lightweight champion.
Kelvingon
Welcome to our official site! Get to know the history, players and latest news of Inter Miami Football Club https://inter-miami.com.az. Discover with us the successes and great performances of America’s newest and most exciting soccer club.
Arturospumb
Conor Anthony McGregor https://conor-mcgregor.com.az Irish mixed martial arts fighter who also performed in professional boxing. He performs under the auspices of the UFC in the lightweight weight category. Former UFC lightweight and featherweight champion.
AnthonyGon
Оперативный вывод из запоя https://www.liveinternet.ru/users/laralim/post505923855/ на дому. Срочный выезд частного опытного нарколога круглосуточно. При необходимости больного госпитализируют в стационар.
CraigSeach
Видеопродакшн студия https://humanvideo.ru полного цикла. Современное оборудование продакшн-компании позволяет снимать видеоролики, фильмы и клипы высокого качества. Создание эффективных видеороликов для рекламы, мероприятий, видеоролики для бизнеса.
Justingut
Заказать вывоз мусора https://musorovozzz.ru в Москве и Московской области, недорого и в любое время суток в мешках или контейнерами 8 м?, 20 м?, 27 м?, 38 м?, собственный автопарк. Заключаем договора на вывоз мусора.
Arturospumb
Реальные анкеты проститутки москвы Москвы с проверенными фото – от элитных путан до дешевых шлюх. Каталог всех индивидуалок на каждой станции метро с реальными фотографиями без ретуши и с отзывами реальных клиентов.
Anthonybyday
Совсем недавно открылся новый интернет портал BlackSprut (Блекспрут) https://bs2cite.cc в даркнете, который предлагает купить нелегальные товары и заказать запрещенные услуги. Самая крупнейшая площадка СНГ. Любимые шопы и отзывчивая поддержка.
Raymondurile
Welcome to the site dedicated to Michael Jordan https://michael-jordan.com.az, a basketball legend and symbol of world sports culture. Here you will find highlights, career, family and news about one of the greatest athletes of all time.
JerryWhicy
Diego Armando Maradona https://diego-maradona.com.az Argentine footballer who played as an attacking midfielder and striker. He played for the clubs Argentinos Juniors, Boca Juniors, Barcelona, ??Napoli, and Sevilla.
EnriqueOnevy
Muhammad Ali https://muhammad-ali.com.az American professional boxer who competed in the heavy weight category; one of the most famous boxers in the history of world boxing.
Chrisfug
Монтаж систем отопления https://fectum.pro, водоснабжения, вентиляции, канализации, очистки воды, пылеудаления, снеготаяния, гелиосистем в Краснодаре под ключ.
Philliplorne
Usain St. Leo Bolt https://usain-bolt.com.az Jamaican track and field athlete, specialized in short-distance running, eight-time Olympic champion and 11-time world champion (a record in the history of this competition among men).
Edgarsug
Al-Nasr https://al-nasr.com.az your source of news and information about Al-Nasr Football Club . Find out the latest results, transfer news, player and manager interviews, fixtures and much more.
Donaldvulge
You have a source of the latest and most interesting sports news from Kazakhstan: “Kazakhstan sports news https://sports-kazahstan.kz: Games and records” ! Follow us to receive updates and interesting news every minute!
CharlesBok
Latest news and information about the NBA https://basketball-kz.kz in Kazakhstan. Hot stories, player transfers and highlights. Watch the NBA world with us.
RodneyAluch
Top sports news https://sport-kz-news.kz, photos and blogs from experts and famous athletes, as well as statistics and information about matches of leading championships.
LeslieCox
Latest news about games for Android https://android-games.kz, reviews and daily updates. Read now and get the latest information about the most exciting games
ThomasAmani
Check out Minecraft kz https://minecraft-kz.kz for the latest news, guides, and in-depth reviews of the game options available. Find the latest information on Minecraft Download, Pocket Edition and Bedrock Edition.
BrettHuddy
Latest news and analysis of the Premier League https://premier-league.kz. Full descriptions of matches, team statistics and the most interesting football events. Premier Kazakhstan is the best place for football fans.
Thomaszen
Доставка груза и грузоперевозки https://tamozhennyy-deklarant.blogspot.com по России через транспортную компанию автотранспортом доступна и для частных лиц. Перевозчик отправит или доставит ваш груз: выгодные тарифы индивидуальный подход из рук в руки 1 машиной.
MichaelJof
Зеркала интерьерные https://zerkala-mag.ru в интернет-магазине «Зеркала с подсветкой» Самые низкие цены на зеркала!
JamesMar
Предлагаем купить гаражное оборудование https://profcomplex.pro, автохимию, технику и уборочный инвентарь для клининговых компаний. Доставка по Москве и другим городам России.
Kennethfen
Купить зеркала https://zerkala-m.ru по низким ценам. Более 1980 моделей, купить недорого в интернет-магазине в Москве с доставкой по России. Удобный каталог, низкие цены, качественные фото.
LewisDrype
Spider-Man https://spiderman.kz the latest news, articles, reviews, dates, spoilers and other latest information. All materials on the topic “Spider-Man”
StaceyImmub
Latest Counter-Strike 2 news https://counter-strike-kz.kz, watch the most successful tournaments and be the best in the gaming world.
Albertopruri
Discover the dynamic world of Arab sports https://sports-ar.com through the lens of Arab sports news. Your premier source for breaking news, exclusive interviews, in-depth analysis and live coverage of everything happening in sports.
PatrickRof
Интернет магазин электроники https://techno-line.store и цифровой техники по доступным ценам. Доставка мобильной электроники по Москве и Московской области.
Jasoncum
NHL news https://nhl-ar.com (National Hockey League) – the latest and most up-to-date NHL news for today.
KermitJat
UFC news https://ufc-ar.com, schedule of fights and tournaments 2024, ratings of UFC fighters, interviews, photos and videos. Live broadcasts and broadcasts of tournaments, statistics, forums and fan blogs.
RonaldCrors
The most important sports news https://bein-sport-egypt.com, photos and blogs from experts and famous athletes, as well as statistics and information about matches of leading leagues.
RichardBog
News and events of the American Basketball League https://basketball-eg.com in Egypt. Hot events, player transfers and the most interesting events. Explore the world of the NBA with us.
WilliamQualm
Discover the wonderful world of online games https://game-news-ar.com. Get the latest news, reviews and tips for your favorite games.
FelixAddit
Minecraft news https://minecraft-ar.com, guides and in-depth reviews of the gaming features available in Minecraft Ar. Get the latest information on downloading Minecraft, Pocket Edition and Bedrock Edition.
Brandonphymn
News, tournaments, guides and strategies about the latest GTA games https://gta-ar.com. Stay tuned for the best GTA gaming experience
Robertisoma
Latest news https://android-games-ar.com about Android games, reviews and daily updates. The latest information about the most exciting games.
Xlokup
order ondansetron 8mg pills – buy ropinirole pills cost requip
RonnieStict
Открытие для себя Ерлинг Хааланда https://manchestercity.erling-haaland-cz.com, a talented player of «Manchester City». Learn more about his skills, achievements and career growth.
Charlesvep
The site is dedicated to football https://fooball-egypt.com, football history and news. Latest news and fresh reviews of the world of football
VictorCek
French prodigy Kylian Mbappe https://realmadrid.kylian-mbappe-cz.com is taking football by storm, joining his main target, ” Real.” New titles and records are expected.
Aarontam
Harry Kane’s journey https://bavaria.harry-kane-cz.com from Tottenham’s leading striker to Bayern’s leader and Champions League champion – this is the story of a triumphant ascent to the football Olympus.
RobertPex
Изготовим для Вас изделия из металла https://smith-moskva.blogspot.com, по вашим чертежам или по нашим эскизам.
JamesEcota
Промышленные насосы https://1nsk.ru/news/articles/nasosy-spetsialnogo-naznacheniya.html Wilo предлагают широкий ассортимент решений для различных отраслей промышленности, включая водоснабжение, отопление, вентиляцию, кондиционирование и многие другие. Благодаря своей высокой производительности и эффективности, насосы Wilo помогают снизить расходы на энергию и обслуживание, что делает их идеальным выбором для вашего бизнеса.
ThomasPethy
https://buzard.ru панели для отделки фасада – интернет магазин
Patrickker
The fascinating story of the rise of Brazilian prodigy Vinicius Junior https://realmadrid.vinicius-junior-cz.com to the heights of glory as part of the legendary Madrid “Real”
WilliamOntom
Mohamed Salah https://liverpool.mohamed-salah-cz.com, who grew up in a small town in Egypt, conquered Europe and became Liverpool star and one of the best players in the world.
Hermanhob
The inspiring story of how talented Kevin De Bruyne https://manchestercity.kevin-de-bruyne-cz.com became the best player of Manchester City and the Belgium national team. From humble origins to the leader of a top club.
RobbieNug
Полезные советы и пошаговые инструкции по строительству https://svoyugol.by, ремонту и дизайну домов и квартир, выбору материалов, монтажу и установке своими руками.
BrianCrazy
Bernardo Mota Veiga de Carvalho e Silva https://manchestercity.bernardo-silva-cz.com Portuguese footballer, club midfielder Manchester City and the Portuguese national team.
OrvilleAdods
Lionel Messi https://intermiami.lionel-messi-cz.com, one of the best football players of all time, moves to Inter Miami” and changes the face of North American football.
JamesTOppy
Antoine Griezmann https://atlticomadrid-dhb.antoine-griezmann-cz.com Atletico Madrid star whose talent and decisive goals helped the club reach the top of La Liga and the UEFA Champions League.
Oopdpc
buy ascorbic acid 500mg pills – buy ferrous pills for sale buy prochlorperazine tablets
Williamcoese
Son Heung-min’s https://tottenhamhotspur.son-heung-min-cz.com success story at Tottenham Hotspur and his influence on the South Korean football, youth inspiration and changing the perception of Asian players.
BernardRig
The story of Robert Lewandowski https://barcelona.robert-lewandowski-cz.com, his impressive journey from Poland to Barcelona, ??where he became not only a leader on the field, but also a source of inspiration for young players.
RaymondSor
The impact of the arrival of Cristiano Ronaldo https://annasr.cristiano-ronaldo-cz.com at Al-Nasr. From sporting triumphs to cultural changes in Saudi football.
Anthonyhox
Find out how Pedri https://barcelona.pedri-cz.com becomes a key figure for Barcelona – his development, influence and ambitions determine the club’s future success in world football.
BradleySpowl
A study of the influence of Rodrigo https://realmadrid.rodrygo-cz.com on the success and marketing strategy of Real Madrid: analysis of technical skills, popularity in Media and commercial success.
Robertslups
How Karim Benzema https://alIttihad.karim-benzema-cz.com changed the game of Al-Ittihad and Saudi football: new tactics, championship success, increased viewership and commercial success.
JasperVence
Find out about Alisson https://liverpool.alisson-becker-cz.com‘s influence on Liverpool’s success, from his defense to personal achievements that made him one of the best goalkeepers in the world.
Waynelew
Find out how Pedro Gavi https://barcelona.gavi-cz.com helped Barcelona achieve success thanks to his unique qualities, technique and leadership, becoming a key player in the team.
DennisNange
buy real instagram followers buy instagram followers
GeorgeCob
Thibaut Courtois https://realmadrid.thibaut-courtois-cz.com the indispensable goalkeeper of “Real”, whose reliability, leadership and outstanding The game made him a key figure in the club.
JamesKex
Find out how Virgil van Dijk https://liverpool.virgil-van-dijk-cz.com became an integral part of style игры «Liverpool», ensuring the stability and success of the team.
RonaldHence
Find out how Bruno Guimaraes https://newcastleunited.bruno-guimaraes-cz.com became a catalyst for the success of Newcastle United thanks to his technical abilities and leadership on the field and beyond.
JoshuaDen
Study of the playing style of Toni Kroos https://real-madrid.toni-kroos-cz.com at Real Madrid: his accurate passing, tactical flexibility and influence on the team’s success.
Curtisfloog
Romelu Lukaku https://chelsea.romelu-lukaku-cz.com, one of the best strikers in Europe, returns to Chelsea to continue climbing to the top of the football Olympus.
WalterAmete
The young Uruguayan Darwin Nunez https://liverpool.darwin-nunez-cz.com broke into the elite of world football, and he became a key Liverpool player.
JimmyLum
Star Brazilian striker Gabriel Jesus https://arsenal.gabriel-jesus-cz.com put in a superb performance to lead Arsenal to new heights after moving from Manchester City.
Jaimeglold
A fascinating story about how David Alaba https://realmadrid.david-alaba-cz.com after starting his career at the Austrian academy Vienna became a key player and leader of the legendary Real Madrid.
KennethTougs
The story of how the incredibly talented footballer Riyad Mahrez https://alahli.riyad-mahrez-cz.com reached new heights in career, moving to Al Ahly and leading the team to victory.
Zacherygroms
The fascinating story of Marcus Rashford’s ascent https://manchester-united.marcus-rashford-cz.com to glory in the Red Devils: from a young talent to one of the key players of the team.
Robertapoda
Fascinating event related to this Keanu Reeves helped him in the role of the iconic John Wick characters https://john-wick.keanu-reeves.cz, among which there is another talent who has combat smarts with inappropriate charisma.
CalvinstOge
Try to make a fascinating actor Johnny Depp https://secret-window.johnny-depp.cz, who will become the slave of his strong hero Moudriho Creeps in the thriller “Secret Window”.
Richarddar
Jackie Chan https://peakhour.jackie-chan.cz from a poor boy from Hong Kong to a world famous Hollywood stuntman. The incredible success story of Jackie Chan.
DavidIminc
Follow Liam Neeson’s career https://hostage.liam-neeson.cz as he fulfills his potential as Brian Mills in the film “Taken” and becomes one of the leading stars of Hollywood action films.
Robertdriff
Emily Olivia Laura Blunt https://oppenheimer.emily-blunt.cz British and American actress. Winner of the Golden Globe (2007) and Screen Actors Guild (2019) awards.
GarryUphog
The inspiring story of Zendaya’s rise https://spider-man.zendaya-maree.cz, from her early roles to her blockbuster debut in Marvel Cinematic Universe.
Derricksep
The inspiring story of the ascent of the young actress Anya Taylor https://queensmove.anya-taylor-joy.cz to fame after her breakthrough performance in the TV series “The Queen’s Move”. Conquering new peaks.
Edwardgam
An indomitable spirit, incredible skills and five championships – how Kobe Bryant https://losangeles-lakers.kobe-bryant.cz became an icon of the Los Angeles Lakers and the entire NBA world.
DariusDal
Carlos Vemola https://oktagon-mma.karlos-vemola.cz Czech professional mixed martial artist, former bodybuilder, wrestler and member Sokol.
Raymondaudic
Witness the thrilling story of Jiri Prochazka’s https://ufc.jiri-prochazka-ufc.cz rapid rise to the top of the UFC’s light heavyweight division, marked by his dynamic fighting style and relentless determination.
Henrypem
An article about the triumphant 2023 Ferrari https://ferrari.charles-leclerc.cz and their star driver Charles Leclerc, who became the Formula world champion 1.
StacyKic
Jon Jones https://ufc.jon-jones.cz a dominant fighter with unrivaled skill, technique and physique who has conquered the light heavyweight division.
DouglasLause
The legendary Spanish racer Fernando Alonso https://formula-1.fernando-alonso.cz returns to Formula 1 after several years.
EarnestSmexY
Young Briton Lando Norris https://mclaren.lando-norris.cz is at the heart of McLaren’s Formula 1 renaissance, regularly achieving podium finishes and winning.
Jamessab
Activision and Call of Duty https://activision.call-of-duty.cz leading video game publisher and iconic shooter with a long history market dominance.
Williamneini
the most popular sports website https://sports-forecasts.com in the Arab world with the latest sports news, predictions and analysis in real time.
AaronWhole
Latest news and analysis of the English Premier League https://epl-ar.com. Detailed descriptions of matches, team statistics and the most interesting football events.
RobertMug
Free movies https://www.moviesjoy.cc and TV streaming online, watch movies online in HD 1080p.
JamesLor
Latest Diablo news https://diablo-ar.com, detailed game descriptions and guides. Diablo.az – The largest Diablo information portal in Arabic.
DavidBet
Latest World of Warcraft tournament news https://ar-wow.com (WOW), strategies and game analysis. The most detailed gaming portal in Arabic.
RosarioRoaby
The latest analysis, reviews of https://spider-man-ar.com tournaments and the most interesting things from the “Spider-Man” series of games in Azerbaijani language. It’s all here!
Eddieoweft
NFL https://nfl-ar.com News, analysis and topics about the latest practices, victories and records. A portal that explores the most beautiful games in the NFL world in general.
Jamesbow
Discover exciting virtual football https://fortnite-ar.com in Fortnite. Your central hub for the latest news, expert strategy and exciting eSports reporting.
Robertmarry
Latest Counter-Strike 2 news https://counter-strike-ar.com, watch the most successful tournaments and be the best in the gaming world on CS2 ar.
RaymondALUMN
Latest boxing news, achievements of Raisol Abbasov https://boxing-ar.com, Tyson Fury fights and much more. It’s all about the boxing ambassador.
KennethAneme
Latest news from the world of boxing https://boks-uz.com, achievements of Resul Abbasov, Tyson Fury’s fights and much more. Everything Boxing Ambassador has.
ScottDap
Discover the wonderful world of online games https://onlayn-oyinlar.com with GameHub. Get the latest news, reviews and tips for your favorite games. Join our gaming community today!
JoshuaHaf
Sports news https://gta-uzbek.com the most respected sports site in Uzbekistan, which contains the latest sports news, forecasts and analysis.
JamesDex
Latest GTA game news https://gta-uzbek.com, tournaments, guides and strategies. Stay tuned for the best GTA gaming experience
JamesDiobe
Explore the extraordinary journey of Kylian Mbappe https://mbappe-real-madrid.com, from his humble beginnings to global stardom.
PhillipMip
Latest news about Pele https://mesut-ozil-uz.com, statistics, photos and much more. Get the latest news and information about football legend Pele.
Stevenirral
Get the latest https://mesut-ozil-uz.com Mesut Ozil news, stats, photos and more.
Stevenraibe
Serxio Ramos Garsiya https://serxio-ramos.com ispaniyalik futbolchi, himoyachi. Ispaniya terma jamoasining sobiq futbolchisi. 16 mavsum davomida u “Real Madrid”da markaziy himoyachi sifatida o’ynadi.
RobertMix
Ronaldo de Asis Moreira https://ronaldinyo.com braziliyalik futbolchi, yarim himoyachi va hujumchi sifatida o’ynagan. Jahon chempioni (2002). “Oltin to’p” sovrindori (2005).
OrlandoNit
Официальный сайт онлайн-казино Vavada https://vavada-kz-game.kz это новый адрес лучших слотов и джекпотов. Ознакомьтесь с бонусами и играйте на реальные деньги из Казахстана.
Anthonygox
Marcus Lilian Thuram-Julien https://internationale.marcus-thuram-fr.com French footballer, forward for the Internazionale club and French national team.
EdwardCor
Manchester City and Erling Haaland https://manchester-city.erling-haaland-fr.com explosive synergy in action. How a club and a footballer light up stadiums with their dynamic play.
WarrenLit
Lionel Messi https://inter-miami.lionel-messi-fr.com legendary Argentine footballer, announced his transfer to the American club Inter Miami.
Zopzmh
purchase durex gel sale – buy generic xalatan for sale purchase xalatan online
Davidved
The official website where you can find everything about the career of Gianluigi Buffon https://gianluigi-buffon.com. Discover the story of this legendary goalkeeper who left his mark on football history and relive his achievements and unforgettable memories with us.
RockyHof
Website dedicated to football player Paul Pogba https://pogba-uz.com. Latest news from the world of football.
Jamesmax
Welcome to our official website! Go deeper into Paulo Dybala’s https://paulo-dybala.com football career. Discover Dybala’s unforgettable moments, amazing talents and fascinating journey in the world of football on this site.
JosephNeink
Coffeeroom https://coffeeroom.by – магазин кофе, чая, кофетехники, посуды, химии и аксессуаров в Минске для дома и офиса.
Everettbub
Прокат и аренда автомобилей https://autorent.by в Минске 2019-2022. Сутки от 35 руб.
ScottAnilm
Find the latest information on Khabib Nurmagomedov https://khabib-nurmagomedov.uz news and fights. Check out articles and videos detailing Khabib UFC career, interviews, wins, and biography.
Timothypaype
Latest news and information about Marcelo https://marselo-uz.com on this site! Find Marcelo’s biography, career, game stats and more.
RobertErage
Discover how Riyad Mahrez https://al-ahli.riyad-mahrez.com transformed Al-Ahli, becoming a key player and catalyst in reaching new heights in world football.
AngelstilL
Find the latest information on Conor McGregor https://conor-mcgregor.uz news, fights, and interviews. Check out detailed articles and news about McGregor’s UFC career, wins, training, and personal life.
Williamhem
Explore the dynamic world of sports https://noticias-esportivas-br.org through the lens of a sports reporter. Your source for breaking news, exclusive interviews, in-depth analysis and live coverage of all sports.
Davidkew
Get to know the history, players and latest news of the Inter Miami football club https://inter-miami.uz. Join us to learn about the successes and great performances of America’s newest and most exciting soccer club.
Jamesapeme
A site dedicated to Michael Jordan https://michael-jordan.uz, a basketball legend and symbol of world sports culture. Here you will find highlights, career, family and news about one of the greatest athletes of all time.
JorgeDweve
The latest top football news https://futebol-ao-vivo.net today. Interviews with football players, online broadcasts and match results, analytics and football forecasts
WilliamLed
Site with the latest news, statistics, photos of Pele https://edson-arantes-do-nascimento.com and much more. Get the latest news and information about football legend Pele.
Jimmysef
Welcome to our official website, where you will find everything about the career of Gianluigi Buffon https://gianluigi-buffon.org. Discover the story of this legendary goalkeeper who made football history.
CharlesDuams
If you are a fan of UFC https://ufc-hoje.com the most famous organization in the world, come visit us. The most important news and highlights from the UFC world await you on our website.
Gabrielgex
Vinicius Junior https://vinicius-junior.org all the latest current and latest news for today about the player of the 2024 season
Allenvug
Analysis of Arsenal’s impressive revival https://arsenal.bukayo-saka.biz under the leadership of Mikel Arteta and the key role of young star Bukayo Saki in the club’s return to the top.
Jesselof
Gavi’s success story https://barcelona.gavi-fr.com at Barcelona: from his debut at 16 to a key role in club and national team of Spain, his talent inspires the world of football.
Henrytroli
Discover the journey of Charles Leclerc https://ferrari.charles-leclerc-fr.com, from young Monegasque driver to Ferrari Formula 1 leader, from his early years to his main achievements within the team.
WilliamThuby
Discover Pierre Gasly’s https://alpine.pierre-gasly.com journey through the world of Formula 1, from his beginnings with Toro Rosso to his extraordinary achievements with Alpine.
JeffreyLot
Discover the story of Rudy Gobert https://minnesota-timberwolves.rudy-gobert.biz, the French basketball player whose defensive play and leadership transformed the Minnesota Timberwolves into a powerhouse NBA team.
Jamesner
From childhood teams to championship victories, the path to success with the Los Angeles Lakers https://los-angeles-lakers.lebron-james-fr.com requires not only talent, but also undeniable dedication and work.
JamesDaced
Leroy Sane’s https://bavaria.leroy-sane-ft.com success story at FC Bayern Munich: from adaptation to influence on the club’s results. Inspiration for hard work and professionalism in football.
Rodgerinany
The story of the Moroccan footballer https://al-hilal.yassine-bounou.com, who became a star at Al-Hilal, traces his journey from the streets of Casablanca to international football stardom and his personal development.
DonaldPrier
Victor Wembanyama’s travel postcard https://san-antonio-spurs.victor-wembanyama.biz from his career in France to his impact in the NBA with the San Antonio Spurs.
StanleyDig
Neymar https://al-hilal.neymar-fr.com at Al-Hilal: his professionalism and talent inspire young people players, taking the club to new heights in Asian football.
AnthonyMed
The history of Michael Jordan’s Chicago Bulls https://chicago-bulls.michael-jordan-fr.com extends from his rookie in 1984 to a six-time NBA championship.
Zacharysmido
Golden State Warriors success story https://golden-state-warriors.stephen-curry-fr.com Stephen Curry: From becoming a leader to creating a basketball dynasty that redefined the game.
ThomasBib
Del Mar Energy Inc is an international industrial holding company engaged in the extraction of oil, gas, and coal
BrianCrony
The success story of the French footballer https://juventus.thierry-henry.biz at Juventus: from his career at the club to leadership on the field , becoming a legend and a source of inspiration for youth.
BruceSic
The story of the great Kobe Bryant https://los-angeles-lakers.kobe-bryant-fr.com with ” Los Angeles Lakers: his path to the championship, his legendary achievements.
WilliamBialp
Novak Djokovic’s https://tennis.novak-djokovic-fr.biz journey from childhood to the top of world tennis: early years, first victories, dominance and influence on the sport.
Claudeslery
Find out the story of Jon Jones https://ufc.jon-jones-fr.biz in the UFC: his triumphs, records and controversies, which made him one of the greatest fighters in the MMA world.
RandyNig
Carlos Alcaraz https://tennis.carlos-alcaraz-fr.biz from a talented junior to the ATP top 10. His rise is the result of hard work, support and impressive victories at major world tournaments.
Dennykit
The fascinating story of Daniil Medvedev’s https://tennis.daniil-medvedev-fr.biz rise to world number one. Find out how a Russian tennis player quickly broke into the elite and conquered the tennis Olympus.
CarlosJop
The fascinating story of Alexander Zverev’s https://tennis.alexander-zverev-fr.biz rapid rise from a junior star to one of the leaders of modern tennis.
Thomasjax
Discover Casper Ruud’s https://tennis.casper-ruud-fr.com journey from his Challenger debut to the top 10 of the world tennis rankings. A unique success.
Ckngoj
rogaine online buy – order rogaine finasteride 5mg drug
Andrehible
The powerful story of Conor McGregor’s https://ufc.conor-mcgregor-fr.biz rise to a two-division UFC championship that forever changed the landscape of mixed martial arts.
JustinZek
The fascinating story of how Lewis Hamilton https://mercedes.lewis-hamilton-fr.biz became a seven-time Formula 1 world champion after signing with Mercedes.
Frankhax
The fascinating story of the creation and rapid growth of Facebook https://facebook.mark-zuckerberg-fr.biz under the leadership of Mark Zuckerberg, who became one of the most influential technology entrepreneurs of our time.
Mariontruth
Kim Kardashian’s https://the-kardashians.kim-kardashian-fr.com incredible success story, from sex scandal to pop culture icon and billion-dollar fortune.
Richardwom
Max Verstappen and Red Bull Racing’s https://red-bull-racing.max-verstappen-fr.com path to success in Formula 1. A story of talent, determination and team support leading to a championship title.
RobertDAL
The astonishing story of Emmanuel Macron’s https://president-of-france.emmanuel-macron-fr.com political rise from bank director to the highest office in France.
Thomaswah
The story of Joe Biden’s https://president-of-the-usa.joe-biden-fr.com triumphant journey, overcoming many obstacles on his path to the White House and becoming the 46th President of the United States.
Erwinvam
Une ascension fulgurante au pouvoir Donald Trump https://usa.donald-trump-fr.com et son empire commercial
Tariortqx
Здравствуйте!
Где купить диплом специалиста?
Приобрести диплом ВУЗа.
https://wikireality.ru/wiki/Будо-форум
Рады оказать помощь!
Diplomi_tcka
купить свидетельство об усыновлении [url=https://ast-diplomas.com/]ast-diplomas.com[/url] .
BrianZES
Здравствуйте!
Приобрести диплом о высшем образовании.
Мы предлагаем заказать диплом высокого качества, который невозможно отличить от оригинала без использования дорогостоящего оборудования и опытного специалиста.
Где заказать диплом специалиста?
https://school-toksovo.ru/forum/messages/forum1/topic485/message667/?result=new#message667
Успешной учебы!
Lunrhva
Добрый день!
Мы готовы предложить дипломы любой профессии по невысоким ценам.
Мы предлагаем документы техникумов, расположенных на территории всей РФ. Можно купить качественно напечатанный диплом за любой год, включая документы СССР. Дипломы и аттестаты выпускаются на бумаге самого высокого качества. Это позволяет делать настоящие дипломы, которые невозможно отличить от оригиналов. Они будут заверены всеми необходимыми печатями и подписями.
Даем 100% гарантию, что в случае проверки документов работодателем, никаких подозрений не возникнет.
Где купить диплом специалиста?
kotka.listbb.ru/viewtopic.php?f=2&t=156
RobertMix
Parisian PSG https://paris.psg-fr.com is one of the most successful and ambitious football clubs in Europe. Find out how he became a global football superstar.
Matthewfed
Travel to the pinnacle of French football https://stadede-bordeaux.bordeaux-fr.org at the Stade de Bordeaux, where the passion of the game meets the grandeur of architecture.
LarryTuh
The fascinating story of Gigi Hadid’s rise to Victoria’s Secret Angel https://victorias-secret.gigi-hadid-fr.com status and her journey to the top of the modeling industry.
JimmyNox
Olympique de Marseille https://liga1.marseilles-fr.com after several years in the shadows, once again becomes champion of France. How did they do it and what prospects open up for the club
Craiglix
The fascinating story of the creation and meteoric rise of Amazon https://amazon.jeff-bezos-fr.com from its humble beginnings as an online bookstore to its dominant force in the world of e-commerce.
AndreGlask
The inspiring story of Travis Scott’s https://yeezus.travis-scott-fr.com rise from emerging artist to one of modern hip-hop’s brightest stars through his collaboration with Kanye West.
Danielbal
A fascinating story about how Elon Musk https://spacex.elon-musk-fr.com and his company SpaceX revolutionized space exploration, opening new horizons for humanity.
WilliamChusa
An exploration of Nicole Kidman’s https://watch.nicole-kidman-fr.com career, her notable roles, and her continued quest for excellence as an actress.
Marvinburry
How Taylor Swift https://midnights.taylor-swift-fr.com reinvented her sound and image on the intimate and reflective album “Midnights,” revealing new dimensions of her talent.
MitchelPet
Explore the rich history and unrivaled atmosphere of the iconic Old Trafford Stadium https://old-trafford.manchester-united-fr.com, home of one of the world’s most decorated football clubs, Manchester United.
Thomasothed
ulcinj montenegro https://weather-webcam-in-montenegro.com
EddieGet
Единственная в России студия кастомных париков https://wigdealers.ru, где мастера индивидуально подбирают структуру волос и основу по форме головы, после чего стригут, окрашивают, делают укладку и доводят до идеала ваш будущий аксессуар.
BrianUnorp
The iconic Anfield https://enfield.liverpool-fr.com stadium and the passionate Liverpool fans are an integral part of English football culture.
Bobbynon
An exploration of the history of Turin’s https://turin.juventus-fr.org iconic football club – Juventus – its rivalries, success and influence on Italian football.
RobertBlels
The new Premier League https://premier-league.chelsea-fr.com season has gotten off to an intriguing start, with a new-look Chelsea looking to return to the Champions League, but serious challenges lie ahead.
Uazrjxa
Добрый день!
Заказать диплом любого ВУЗа
Наша компания предлагает выгодно купить диплом, который выполнен на оригинальном бланке и заверен печатями, водяными знаками, подписями должностных лиц. Диплом способен пройти любые проверки, даже с применением специального оборудования. Решайте свои задачи быстро и просто с нашими дипломами.
Где заказать диплом по необходимой специальности?
https://www.anytalkworld.com/create-blog/
Будем рады вам помочь!.
Diplomi_raKn
можно ли купить настоящий диплом о высшем образовании можно ли купить настоящий диплом о высшем образовании .
Diplomi_baSi
купить аттестаты об основном общем образовании diplomyx.com .
Diplomi_vmmr
где купить диплом техникума [url=https://ast-diploms.com/]ast-diploms.com[/url] .
MelvinThoke
Inter Miami FC https://mls.inter-miami-fr.com has become a major player in MLS thanks to its star roster, economic growth and international influence.
Derricktoica
Explore the career and significance of Monica Bellucci https://malena.monica-bellucci-fr.com in Malena (2000), which explores complex themes of beauty and human strength in wartime.
BruceNEF
Discover Rafael Nadal’s https://mls.inter-miami-fr.com impressive rise to the top of world tennis, from his debut to his career Grand Slam victory.
Anthonyguess
The story of Kanye West https://the-college-dropout.kanye-west-fr.com, starting with his debut album “The College Dropout,” which changed hip-hop and became his cultural legacy.
Trefzbw
Здравствуйте!
Хочу поделиться своим опытом по заказу аттестата ПТУ. Думал, что это невозможно, и начал искать информацию в интернете по теме: купить диплом с занесением в реестр, купить диплом колледжа, купить диплом в волгодонске, купить диплом в орске, купить диплом в коврове. Постепенно углубляясь, нашел отличный ресурс здесь: http://www.apicarrara.it/modules.php?name=Journal&file=display&jid=3998, и остался очень доволен!
Теперь у меня есть диплом сварщика о среднем специальном образовании, и я обеспечен на всю жизнь!
Успехов в учебе!
Gabrielwoofe
Преимущества аренды склада https://bro-droider.ru/2024/07/04/аренда-склада-от-собственника-в-новой/, как аренда складских помещений может улучшить ваш бизнес
Thomaszed
Rivaldo, or Rivaldo https://barcelona.rivaldo-br.com, is one of the greatest football players to ever play for Barcelona.
JasonVuche
A fascinating story about Brazilian veteran Thiago Silva’s https://chelsea.thiago-silva.net difficult path to the top of European football as part of Chelsea London.
Pvyivp
order leflunomide 10mg – cartidin canada order cartidin generic
RobertVet
Cristiano Ronaldo https://al-nassr.cristianoronaldo-br.net one of the greatest football players of all time, begins a new chapter in his career by joining An Nasr Club.
Stevenanerb
The story of Luka Modric’s rise https://real-madrid.lukamodric-br.com from young talent to one of the greatest midfielders of his generation and a key player for the Royals.
LouisLet
The fascinating story of Marcus Rashford’s rise https://manchester-united.marcusrashford-br.com from academy youth to the main striker and captain of Manchester United. Read about his meteoric rise and colorful career.
Robertloyax
From academy product to captain and leader of Real Madrid https://real-madrid.ikercasillas-br.com Casillas became one of the greatest players in the history of Real Madrid.
DonaldDient
Follow Bernardo Silva’s impressive career https://manchester-city.bernardosilva.net from his debut at Monaco to to his status as a key player and leader of Manchester City.
Diplomi_rxka
вуз инфо ast-diplomas.com .
Williamarept
рио бет казино bookparts.ru
TimothyAwaip
рио бет казино официальный сайт риобет казино
JosephBon
регистрация драгон мани казино uvstyle.ru
MauriceLag
сайт драгон мани казино реристрация Dragon Money Casino
ChuckLor
Лучшие пансионаты для пожилых людей https://ernst-neizvestniy.ru в Самаре – недорогие дома для престарелых в Самарской области
WilliammEf
Пансионаты для пожилых людей https://moyomesto.ru в Самаре по доступным ценам. Специальные условия по уходу, индивидуальные программы.
CharlesBoymn
The fascinating story of Sergio Ramos’ https://seville.sergioramos.net rise from Sevilla graduate to one of Real Madrid and Spain’s greatest defenders.
Jesusnuani
Ousmane Dembele’s https://paris-saint-germain.ousmanedembele-br.com rise from promising talent to key player for French football giants Paris Saint-Germain. An exciting success story.
Williamjuche
The incredible success story of 20-year-old Florian Wirtz https://bayer-04.florianwirtz-br.com, who quickly joined the Bayer team and became one of the best young talents in the world.
JustinMum
Midfielder Rafael Veiga leads https://manchester-city.philfoden-br.com Palmeiras to success – the championship Brazilian and victory in the Copa Libertadores at the age of 24.
Robertreirl
The rise of 20-year-old midfielder Jamal Musiala https://bavaria.jamalmusiala-br.com to the status of a winger in the Bayern Munich team. A story of incredible talent.
Diplomi_zcPn
купить диплом кемерово http://diploms-x.com/ .
Williamben
Fabrizio Moretti https://the-strokes.fabriziomoretti-br.com the influential drummer of The Strokes, and his unique sound revolutionized the music scene, remaining icons of modern rock.
Larrygon
Selena Gomez https://calm-down.selenagomez-br.net the story from child star to global musical influence, summarized in hit “Calm Down”, with Rema.
Danrupu
Здравствуйте!
Где приобрести диплом по актуальной специальности?
Мы изготавливаем дипломы любой профессии по невысоким ценам.
vague.social/blogs/31670/Why-is-the-popularity-of-universities-rapidly-declining-today
Trefkfs
Привет всем)
Студенческая жизнь прекрасна, пока не приходит время писать диплом, как это случилось со мной. Не стоит отчаиваться, ведь существуют компании, которые помогают с написанием и защитой диплома на высокие оценки!
Сначала я искал информацию по теме: купить диплом кандидата наук, купить диплом стоматолога, купить диплом инженера строителя, купить диплом в сарове, купить диплом в назрани, а потом наткнулся на https://obmenka.forum2x2.ru/t17060-topic#38554, где все мои учебные проблемы были решены!
Хорошей учебы!
Dyyghm
calan 120mg for sale – buy tenoretic tablets tenoretic for sale online
Diplomi_tukr
где можно купить диплом о среднем образовании где можно купить диплом о среднем образовании .
Gilberthax
Achraf Hakimi https://paris-saint-germain.ashrafhakimi.net is a young Moroccan footballer who quickly reached the football elite European in recent years.
DarrellVurce
Bieber’s https://baby.justinbieber-br.com path to global fame began with his breakthrough success Baby, which became his signature song and one of the most popular music videos of all time.
MichaelTip
Ayrton Senna https://mclaren.ayrtonsenna-br.com is one of the greatest drivers in the history of Formula 1.
EddieFrifs
In the world of professional tennis, the name of Gustavo Kuerten https://roland-garros.gustavokuerten.com is closely linked to one of the most prestigious Grand Slam tournaments – Roland Garros.
Fazrghf
Привет!
Мы изготавливаем дипломы любой профессии по приятным ценам. Стоимость будет зависеть от конкретной специальности, года получения и университета.
Где приобрести диплом по актуальной специальности?
Заказать диплом о высшем образовании
landik-diploms-srednee.ru/kupit-diplom-saratov
Успешной учебы!
Dnrtfff
Привет, друзья!
Заказать документ ВУЗа вы сможете у нас в Москве.
diploms-x24.ru/kupit-diplom-sankt-peterburg
Успехов в учебе!
DwaindorgE
Rodrygo Silva de Goes https://real-madrid.rodrygo-br.com, known simply as Rodrygo, emerged as one of the the brightest young talents in world football.
HerbertThexy
Bruno Miguel Borges Fernandes https://manchester-united.brunofernandes-br.com was born on September 8, 1994 in Maia, Portugal.
JamesNab
Nuno Mendes https://paris-saint-germain.nuno-mendes.com, a talented Portuguese left-back, He quickly became one of the key figures in the Paris Saint-Germain (PSG) team.
Bfipuo
atenolol 100mg generic – buy betapace 40mg online buy generic carvedilol 25mg
TravisNom
Earvin “Magic” Johnson https://los-angeles-lakers.magicjohnson.biz is one of the most legendary basketball players in history. NBA history.
HowardNug
Vinicius Junior https://real-madrid.vinicius-junior-ar.com the Brazilian prodigy whose full name is Vinicius Jose Baixao de Oliveira Junior, has managed to win the hearts of millions of fans around the world in a short period of time.
Leslieimarm
Toni Kroos https://real-madrid.tonikroos-ar.com the German midfielder known for his accurate passes and calmness on the field, has achieved remarkable success at one of the most prestigious football clubs in the world.
Stacysom
Victor Osimhen https://napoli.victorosimhen-ar.com born on December 29, 1998 in Lagos, Nigeria, has grown from an initially humble player to one of the brightest strikers in modern football.
Jasonwag
Robert Lewandowski https://barcelona.robertlewandowski-ar.com is one of the most prominent footballers of our time, and his move to Barcelona has become one of the most talked about topics in world football.
Iariorhql
Легальная покупка диплома о среднем образовании в Москве и регионах
socialsnug.net/read-blog/97
Qazrzmy
Привет!
Где заказать диплом по необходимой специальности?
Мы предлагаем максимально быстро купить диплом, который выполнен на оригинальном бланке и заверен мокрыми печатями, водяными знаками, подписями официальных лиц. Документ пройдет любые проверки, даже при использовании специфических приборов. Достигайте цели быстро с нашей компанией.
Заказать диплом ВУЗа.
mooz6.com/read-blog/654
Dnrtgba
Здравствуйте!
Купить документ института можно в нашей компании в Москве.
diplomasx.com/otzyvy
Удачи!
Diplomi_xokr
Здравствуйте!
Приобрести документ о получении высшего образования вы имеете возможность в нашей компании в столице.
diplomyx24.ru/kupit-diplom-vracha
Pazrbto
Здравствуйте!
Мы изготавливаем дипломы любой профессии по приятным тарифам. Стоимость зависит от выбранной специальности, года получения и университета.
landik-diploms-srednee.ru/svidetelstvo-o-rozhdenii
Успехов в учебе!
Sazrptx
Привет, друзья!
Диплом вуза купить официально с упрощенным обучением в Москве
parenvarmii.ru/viewtopic.php?f=21&t=4394&sid=845d9903225e49ad6b7415ad78579874
Поможем вам всегда!.
Lariordax
Полезная информация как купить диплом о высшем образовании без рисков
ast-diplomy.com/kupit-diplom-sankt-peterburg
Lazrbdd
Привет!
Где купить диплом по нужной специальности?
Купить диплом любого ВУЗа.
lastdemo.primepix.ru/club/user/88/blog/8745/
Diplomi_mcmr
купить диплом техникума недорого ast-diploms.com .
Diplomi_dbPi
можно ли купить школу можно ли купить школу .
Pablogew
Pedro Gonzalez Lopez https://barcelona.pedri-ar.com known as Pedri, was born on November 25, 2002 in the small town of Tegeste, located on Tenerife, one of the Canary Islands.
Manrbbr
Привет, друзья!
Где заказать диплом специалиста?
Мы предлагаем документы ВУЗов, которые находятся в любом регионе Российской Федерации. Можно приобрести качественно напечатанный диплом от любого ВУЗа, за любой год, указав подходящую специальность и оценки за все дисциплины. Дипломы выпускаются на бумаге самого высшего качества. Это дает возможность делать государственные дипломы, не отличимые от оригинала. Документы будут заверены всеми требуемыми печатями и штампами.
Мы предлагаем дипломы любой профессии по приятным ценам.
ast-diplomy24.ru/kupit-diplom-moskva
Рады оказать помощь!
Marceloboymn
The story of Leo Messi https://inter-miami.lionelmessi.ae‘s transfer to Inter Miami began long before the official announcement. Rumors about Messi’s possible departure from Barcelona appeared in 2020
RobertCrora
Andreson Souza Conceicao https://al-nassr.talisca-ar.com known as Talisca, is one of the brightest stars of modern football.
GeorgeEpile
Yacine Bounou https://al-hilal.yassine-bounou-ar.com known simply as Bono, is one of the most prominent Moroccan footballers of our time.
Wazrxqc
Здравствуйте!
Мы можем предложить документы техникумов, расположенных в любом регионе РФ. Вы можете купить диплом от любого учебного заведения, за любой год, включая сюда документы старого образца. Документы выпускаются на “правильной” бумаге высшего качества. Это дает возможность делать государственные дипломы, которые не отличить от оригиналов. Они будут заверены всеми необходимыми печатями и штампами.
microstockhowto.com/tag/community
Dnrtzpl
Привет!
Заказать документ о получении высшего образования вы имеете возможность у нас в столице.
ast-diplomas.com/kupit-diplom-o-srednem-obrazovanii
Успешной учебы!
WilliamMency
Привет, друзья!
Наши специалисты предлагают выгодно и быстро заказать диплом, который выполнен на бланке ГОЗНАКа и заверен печатями, водяными знаками, подписями. Документ способен пройти любые проверки, даже с использованием специального оборудования. Достигайте свои цели быстро и просто с нашей компанией.
drop-let.ru/index.php?subaction=userinfo&user=ojexoq
Успехов в учебе!
Diplomi_iuPn
купить диплом 1999 года выпуска http://www.diploms-x.com .
Uazrmqq
Добрый день!
Где купить диплом специалиста?
testforum.1stbb.ru/posting.php?mode=post&f=3
Удачи!
Danrgmo
Привет!
Где заказать диплом специалиста?
Мы предлагаем дипломы психологов, юристов, экономистов и других профессий по приятным тарифам.
tnrevergreen.com.vn/dien-tich-tim-tuong-la-gi-mua-nha-nen-dung-cach-tinh-dien-tich-nao/
Trefxyg
Добрый день!
Как не стать жертвой мошенников при покупке диплома о среднем полном образовании
velopiter.spb.ru/profile/117605-dilopluyy/?tab=field_core_pfield_1
Окажем помощь!.
Yrefudz
Привет, друзья!
Заказать диплом университета.
promintern.listbb.ru/viewtopic.php?f=16&t=428
Успехов в учебе!
Jamesabuck
Harry Kane https://bayern.harry-kane-ar.com one of the most prominent English footballers of his generation, completed his move to German football club Bayern Munich in 2023.
RonaldAvess
Brazilian footballer Neymar https://al-hilal.neymar-ar.com known for his unique playing style and outstanding achievements in world football, has made a surprise move to Al Hilal Football Club.
Francisgaire
Erling Haaland https://manchester-city.erling-haaland-ar.com born on July 21, 2000 in Leeds, England, began his football journey at an early age.
StephenNob
Luka Modric https://real-madrid.lukamodric-ar.com can certainly be called one of the outstanding midfielders in modern football.
Richardtrips
Football in Saudi Arabia https://al-hilal.ali-al-bulaihi-ar.com has long been one of the main sports, attracting millions of fans. In recent years, one of the brightest stars in Saudi football has been Ali Al-Bulaihi, defender of Al-Hilal Football Club.
Razrkqu
Добрый день!
Наш сервис предлагает заказать диплом в высочайшем качестве, неотличимый от оригинала без участия специалистов высокой квалификации со специальным оборудованием.
kochtagebuch.org/doku.php?id=russianydiplomix
Хорошей учебы!
Sazrchh
Здравствуйте!
Официальная покупка школьного аттестата с упрощенным обучением в Москве
avtovladelez.ru/byistroe-oformlenie-diploma-nadezhno-i-bezopasno
Рады оказать помощь!.
Scottzex
visit my website https://currencyconvert.net
Samuelbit
Сайт https://ps-likers.ru предлагает уроки по фотошоп для начинающих. На страницах сайта можно найти пошаговые руководства по анимации, созданию графики для сайтов, дизайну, работе с текстом и фотографиями, а также различные эффекты.
Williamfap
N’Golo Kante https://al-ittihad.ngolokante-ar.com the French midfielder whose career has embodied perseverance, hard work and skill, has continued his path to success at Al-Ittihad Football Club, based in Saudi Arabia.
CharlespYdaY
Kobe Bryant https://los-angeles-lakers.kobebryant-ar.com also known as the “Black Mamba”, is one of the most iconic and iconic figures in NBA history.
Diplomi_irkr
Привет, друзья!
Купить документ ВУЗа можно в нашей компании в Москве.
asxdiplomik.com/kupit-diplom-moskva
Xazrhbd
Привет, друзья!
Предлагаем документы техникумов, расположенных на территории всей РФ. Вы имеете возможность заказать качественный диплом от любого учебного заведения, за любой год, указав актуальную специальность и хорошие оценки за все дисциплины. Дипломы и аттестаты делаются на бумаге самого высокого качества. Это дает возможность делать государственные дипломы, которые невозможно отличить от оригиналов. Документы заверяются необходимыми печатями и подписями.
Мы предлагаем дипломы психологов, юристов, экономистов и других профессий по приятным тарифам. Стоимость зависит от той или иной специальности, года получения и ВУЗа. Стараемся поддерживать для заказчиков адекватную ценовую политику. Важно, чтобы документы были доступны для большинства граждан.
arusak-diploms-srednee.ru/kupit-diplom-kandidata-nauk
Хорошей учебы!
JeffreyLiedo
RDBox.de https://rdbox.de bietet schallgedammte Gehause fur 3D-Drucker, die eine sehr leise Druckumgebung schaffen – nicht lauter als ein Kuhlschrank. Unsere Losungen sorgen fur stabile Drucktemperatur, Vibrationsisolierung, Luftreinigung und mobile App-Steuerung.
CharlesCab
Karim Benzema https://al-ittihad.karimbenzema.ae is a name worthy of admiration and respect in the world of football.
RogerMaick
Cristiano Ronaldo https://al-nassr.cristiano-ronaldo.ae is one of the greatest names in football history, with his achievements inspiring millions of fans around the world.
WalterPoold
In 2018, the basketball world witnessed one of the most remarkable transformations in NBA history. LeBron James https://los-angeles-lakers.lebronjames-ar.com one of the greatest players of our time, decided to leave his hometown Cleveland Cavaliers and join the Los Angeles Lakers.
Sazrvgr
Привет!
Как приобрести диплом техникума с минимальными рисками
http://www.liveinternet.ru/users/worksale/post506346585
Поможем вам всегда!.
Cazrtjs
Привет, друзья!
Мы можем предложить документы техникумов, которые расположены в любом регионе России. Можно приобрести диплом от любого учебного заведения, за любой год, включая сюда документы старого образца СССР. Дипломы и аттестаты печатаются на “правильной” бумаге самого высокого качества. Это позволяет делать настоящие дипломы, не отличимые от оригиналов. Документы будут заверены необходимыми печатями и штампами.
samovod.ru/content/articles/65991/
Chrispriva
Luis Diaz https://liverpool.luis-diaz-ar.com is a young Colombian striker who has enjoyed rapid growth since joining the ” Liverpool” in January 2022.
WesleyNef
Kevin De Bruyne https://manchester-city.kevin-de-bruyne-ar.com is a name every football fan knows today.
Robertzem
Maria Sharapova https://tennis.maria-sharapova-ar.com was born on April 19, 1987 in Nyagan, Russia. When Masha was 7 years old, her family moved to Florida, where she started playing tennis.
Johnniebop
Roberto Firmino https://al-ahli.roberto-firmino-ar.com one of the most talented and famous Brazilian footballers of our time, has paved his way to success in different leagues and teams.
Philliphalse
Angel Di Maria https://benfica.angel-di-maria-ar.com is a name that will forever remain in the memories of Benfica fans.
Westonskype
Khvicha Kvaratskhelia https://napoli.khvicha-kvaratskhelia-ar.com is a name that in recent years has become a symbol of Georgian football talent and ambition.
Andrewesee
Football in Saudi Arabia https://al-hilal.saud-abdulhamid-ar.com is gaining more and more popularity and recognition on the international stage, and Saud Abdul Hamid, the young and talented defender of Al Hilal, is a shining example of this success.
Nxtdke
buy atorvastatin no prescription – order bystolic 5mg pill order bystolic 20mg without prescription
Peterkab
Казахский национальный технический университет https://satbayev.university им. К.Сатпаева
Kevinleams
Продажа новых автомобилей Hongqi
https://hongqi-krasnoyarsk.ru/hongqi-hs3 в Красноярске у официального дилера Хончи. Весь модельный ряд, все комплектации, выгодные цены, кредит, лизинг, трейд-ин
Davidloove
Kylie Jenner https://kylie-cosmetics.kylie-jenner-ar.com is an American model, media personality, and businesswoman, born on August 10, 1997 in Los Angeles, California.
Btaexe
buy gasex without a prescription – diabecon order order diabecon pill
Lazrvec
Добрый день!
Где купить диплом по нужной специальности?
Заказать диплом любого ВУЗа.
abris-zip.ru/company/personal/user/171/forum/message/1233/1243/
Xazrbnk
Добрый день!
Готовы предложить документы ВУЗов, которые расположены в любом регионе Российской Федерации. Вы можете приобрести диплом от любого учебного заведения, за любой год, указав подходящую специальность и хорошие оценки за все дисциплины. Документы делаются на бумаге самого высшего качества. Это дает возможности делать настоящие дипломы, которые не отличить от оригиналов. Документы будут заверены необходимыми печатями и подписями.
Мы предлагаем дипломы психологов, юристов, экономистов и прочих профессий по доступным ценам. Цена может зависеть от выбранной специальности, года выпуска и образовательного учреждения. Всегда стараемся поддерживать для клиентов адекватную ценовую политику. Для нас важно, чтобы дипломы были доступными для большинства наших граждан.
arusak-diploms-srednee.ru/svidetelstvo-o-brake В
Хорошей учебы!
Diplomi_iqkr
Добрый день!
Купить документ о получении высшего образования можно в нашей компании в Москве.
ast-diplomy.com/kupit-diplom-vracha
Dnrtmwd
Здравствуйте!
Заказать документ университета вы сможете у нас в столице.
ast-diplom.com/kupit-diplom-vracha
Успешной учебы!
Edwardmop
https://foruspharma.com/# mexican online pharmacies prescription drugs
Lariorzav
Можно ли купить аттестат о среднем образовании, основные моменты и вопросы
ast-diploms24.ru/kupit-diplom-voronezh
Davidoceat
trusted canadian pharmacy: canadadrugpharmacy com – canadian medications
Mazrsxo
Привет, друзья!
Как приобрести аттестат о среднем образовании в Москве и других городах
dsac.es/купить-диплом-рпа/
Richardwefly
Bella Hadid https://img-models.bella-hadid-ar.com is an American model who has emerged in recent years as one of the most influential figures in the world of fashion.
Dannydiano
Brazilian footballer Ricardo Escarson https://orlando-city.kaka-ar.com dos Santos Leite, better known as Kaka, is one of the most famous and successful players in football history.
Jasonziz
Sadio Mane https://al-nassr.sadio-mane-ar.com the Senegalese footballer best known for his performances at clubs such as Southampton and Liverpool, has become a prominent figure in Al Nassr.
Diplomi_uemr
купить диплом вуза ссср в кемерово ast-diploms.com .
Diplomi_msPi
купить диплом в нижнекамске diplomasx.com .
Charleskep
canadian pharmacies online certified canadian pharmacy canadian pharmacy no rx needed
Edwardmop
http://indiapharmast.com/# india pharmacy
Louisenhah
Edson Arantes https://santos.pele-ar.com do Nascimento, known as Pele, was born on October 23, 1940 in Tres Coracoes, Minas Gerais, Brazil.
TyroneduB
Monica Bellucci https://dracula.monica-bellucci-ar.com one of the most famous Italian actresses of our time, has a distinguished artistic career spanning many decades. Her talent, charisma, and stunning beauty made her an icon of world cinema.
Diplomi_afki
реально ли купить диплом реально ли купить диплом .
Diplomi_blPn
купить диплом колледжа в екатеринбурге купить диплом колледжа в екатеринбурге .
Dnrtxtu
Привет!
Заказать документ университета можно у нас.
ast-diplomas24.ru/kupit-diplom-moskva
Удачи!
Davidoceat
best online pharmacy india: top 10 pharmacies in india – Online medicine home delivery
Xazrnko
Добрый день!
Приобрести диплом любого ВУЗа
landik-diploms-srednee.ru/diplom-s-reestromkupit-kupit В
Успехов в учебе!
Cazrrgv
Привет!
Мы предлагаем документы ВУЗов, которые находятся в любом регионе России. Можно заказать диплом от любого учебного заведения, за любой год, указав необходимую специальность и оценки за все дисциплины. Дипломы и аттестаты выпускаются на бумаге высшего качества. Это позволяет делать настоящие дипломы, не отличимые от оригинала. Они заверяются необходимыми печатями и штампами.
intgez.com/read-blog/42433
Sazriay
Добрый день!
Пошаговая инструкция по официальной покупке диплома о высшем образовании
artem-energo.ru/message.php?msg=151
Рады оказаться полезными!.
Trefmff
Привет, друзья!
Как купить аттестат 11 класса с официальным упрощенным обучением в Москве
vk.com/unikvseru?w=wall414329581_6828
Рады оказаться полезными!.
Michaelhig
india online pharmacy: п»їlegitimate online pharmacies india – indian pharmacy
BrianBoinc
Brazilian footballer Malcom https://al-hilal.malcom-ar.com (full name Malcom Felipe Silva de Oliveira) achieved great success in Al Hilal, one of the leading football teams in Saudi Arabia and the entire Middle East.
AndrewCaurb
Jackie Chan https://karate-kid.jackiechan-ar.com was born in 1954 in Hong Kong under the name Chan Kong San.
Diplomi_ygkr
Привет!
Заказать документ о получении высшего образования вы можете в нашей компании в Москве.
ast-diplomas.com/kupit-diplom-o-srednem-obrazovanii
Davidoceat
pharmacies in mexico that ship to usa: buying prescription drugs in mexico – mexican rx online
Yrefeht
Привет!
Купить диплом университета.
wallazz.com/blogs/200423/??????-??????-???-???????-?-??????
Успешной учебы!
Charleskep
best online pharmacies in mexico п»їbest mexican online pharmacies reputable mexican pharmacies online
Qazrojs
Добрый день!
Как приобрести аттестат о среднем образовании в Москве и других городах.
Купить диплом ВУЗа.
laporteproperty.com/en/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=127
Edwardmop
https://canadapharmast.com/# canadian mail order pharmacy
Lazrlim
Привет, друзья!
Мы предлагаем дипломы любых профессий по приятным ценам.
medik-look.ru/diplomyi-vyisshego-obrazovaniya-s-garantiey
Michaelhig
vipps approved canadian online pharmacy: onlinecanadianpharmacy – canadian pharmacies online
Davidoceat
online pharmacy india: top 10 online pharmacy in india – mail order pharmacy india
Razrvsk
Здравствуйте!
Мы предлагаем купить диплом высокого качества, неотличимый от оригинала без участия специалистов высокой квалификации с дорогостоящим оборудованием.
pr.lgubiz.net/bbs/board.php?bo_table=free&wr_id=121464
Успешной учебы!
Dnrtdrt
Здравствуйте!
Приобрести документ ВУЗа можно в нашей компании в Москве.
ast-diplomas24.ru/kupit-diplom-ekaterinbur
Удачи!
Manrwds
Добрый день!
Где купить диплом по актуальной специальности?
Мы предлагаем документы ВУЗов, которые находятся в любом регионе Российской Федерации. Вы имеете возможность купить диплом от любого высшего учебного заведения, за любой год, в том числе документы старого образца СССР. Дипломы печатаются на “правильной” бумаге высшего качества. Это позволяет делать настоящие дипломы, которые не отличить от оригиналов. Документы заверяются всеми требуемыми печатями и подписями.
Мы изготавливаем дипломы любых профессий по приятным тарифам.
ast-diplomas24.ru/kupit-diplom-omsk
Рады оказать помощь!
WilliamMency
Добрый день!
Наша компания предлагает быстро и выгодно заказать диплом, который выполнен на оригинальном бланке и заверен печатями, водяными знаками, подписями должностных лиц. Диплом пройдет лубую проверку, даже при использовании профессиональных приборов. Решите свои задачи быстро и просто с нашей компанией.
kvitka.ukrbb.net/viewtopic.php?f=62&t=22635&p=41827#p41827
Хорошей учебы!
Xazrjvb
Привет!
Заказать диплом любого ВУЗа
arusak-diploms-srednee.ru/diplom-sredne-spetcialnoe-obrazovanie В
Успехов в учебе!
Sazrvlz
Здравствуйте!
Официальное получение диплома техникума с упрощенным обучением в Москве
fabnews.ru/forum/showthread.php?p=79938#post79938
Будем рады вам помочь!.
Cazrhvl
Здравствуйте!
Мы предлагаем документы ВУЗов, которые расположены на территории всей Российской Федерации. Можно заказать качественно сделанный диплом от любого учебного заведения, за любой год, указав подходящую специальность и оценки за все дисциплины. Дипломы и аттестаты выпускаются на “правильной” бумаге самого высшего качества. Это позволяет делать государственные дипломы, не отличимые от оригиналов. Документы заверяются необходимыми печатями и подписями.
socialhustle.co.uk/read-blog/2356
Davidoceat
indian pharmacy: Online medicine home delivery – п»їlegitimate online pharmacies india
Uazrrgh
Добрый день!
Приобрести диплом университета.
graph.org/Kak-kupit-diplom-bez-lishnih-hlopot-07-10
Uazrvjy
Привет!
Где купить диплом по актуальной специальности?
comedyforme.ru/vash-shans-na-uspeh-diplom-bez-truda
Успехов в учебе!
Michaelhig
Online medicine home delivery: best india pharmacy – top 10 pharmacies in india
Lazrcxj
Добрый день!
Где заказать диплом по актуальной специальности?
Купить диплом о высшем образовании.
prof-aksay.ru/blogs/1/bolshoy-assortiment-dokumentov-v-izvestnom-internet-magazine.php
Dnrttnd
Привет, друзья!
Заказать документ университета вы имеете возможность в нашем сервисе.
diplomasx24.ru/otzyvy
Удачи!
ThomasErert
http://clomiddelivery.pro/# how to get cheap clomid without rx
Xazrqvn
Привет!
Как получить диплом стоматолога быстро и официально
arusak-diploms-srednee.ru/kupit-diplom-medicinskogo-uchilishha
Sazrplg
Привет, друзья!
Как получить диплом техникума с упрощенным обучением в Москве официально
elderassociation.mn.co/posts/62005565
Всегда вам поможем!
Dibkry
lasuna pills – buy cheap generic lasuna purchase himcolin without prescription
Jamesapacy
Travis Scott https://astroworld.travis-scott-ar.com is one of the brightest stars in the modern hip-hop industry.
DonaldGex
Zinedine Zidane https://real-madrid.zinedine-zidane-ar.com the legendary French footballer, entered the annals of football history as a player and coach.
WilliamErums
The history of one of France’s https://france.paris-saint-germain-ar.com most famous football clubs, Paris Saint-Germain, began in 1970, when capitalist businessmen Henri Delaunay and Jean-Auguste Delbave founded the club in the Paris Saint-Germain-en-Laye area.
Donaldrem
Chelsea https://england.chelsea-ar.com is one of the most successful English football clubs of our time.
CalvinDiuff
Juventus Football Club https://italy.juventus-ar.com is one of the most successful and decorated clubs in the history of Italian and world football.
Trefodg
Привет!
Покупка диплома о среднем полном образовании: как избежать мошенничества?
led119.ru/forum/user/107400/
Рады оказать помощь!.
Lazrirp
Привет, друзья!
Где приобрести диплом специалиста?
Приобрести диплом любого ВУЗа.
textualheritage.org/index.php?option=com_content&task=view&id=1067
Lazrptr
Привет!
Мы можем предложить дипломы любой профессии по приятным ценам.
vseogirls.ru/diplomyi-s-vyisokoy-autentichnostyu
ThomasErert
https://amoxildelivery.pro/# amoxicillin 500 mg tablet
Lariorlld
Удивительно, но купить диплом кандидата наук оказалось не так сложно
diploms-x24.ru/otzyvy
Diplomi_ookr
Здравствуйте!
Купить документ о получении высшего образования вы сможете у нас.
asxdiplomik24.ru/kupit-diplom-omsk
Raymondhitle
Автомобили Hongqi https://hongqi-krasnoyarsk.ru в наличии – официальный дилер Hongqi Красноярск
Matthewkem
Liverpool https://england.liverpool-ar.com holds a special place in the history of football in England.
RobertWot
Priyanka Chopra https://baywatch.priyankachopra-ar.com is an Indian actress, singer, film producer and model who has achieved global success.
Kennethkes
When Taylor Swift https://shake-it-off.taylor-swift-ar.com released “Shake It Off” in 2014, she had no idea how much the song would impact her life and music career.
Dnrtwjw
Привет, друзья!
Купить документ о получении высшего образования можно в нашей компании в Москве.
diplomasx.com/kupit-diplom-krasnoyarsk
Удачи!
Mazrqhv
Привет, друзья!
Узнайте стоимость диплома высшего и среднего образования и процесс получения
vintfint.com/blogs/21171/ упите-?ипломы-Ѕыстро-и-Ќадежно
RobertThuro
Jennifer Lopez https://lets-get-loud.jenniferlopez-ar.com was born in 1969 in the Bronx, New York, to parents who were Puerto Rican immigrants.
Xazrpsm
Здравствуйте!
Покупка диплома о среднем полном образовании: как избежать мошенничества?
arusak-diploms-srednee.ru/kupit-diplom-kandidata-nauk
ThomasErert
http://ciprodelivery.pro/# cipro for sale
Qazryjd
Привет, друзья!
Как официально приобрести аттестат 11 класса с минимальными затратами времени.
Купить диплом любого ВУЗа.
antspride.com/read-blog/824
Diplomi_jqmr
купить диплом москва сколько ast-diploms.com .
Sazrtpw
Привет!
Пошаговая инструкция по официальной покупке диплома о высшем образовании
pyha.ru/forum/topic/13526.1#msg216473
Всегда вам поможем!
Diplomi_dpPi
купить диплом о высшем образовании в уфе купить диплом о высшем образовании в уфе .
Yrefchy
Здравствуйте!
Купить диплом о высшем образовании.
http://www.dr-ay.com/blogs/177535/?????-??-??????????-????-??????-??????-??????
Успехов в учебе!
Christop
After some difficult years in the late 2010s, Manchester United https://england.manchester-united-ar.com returned to greatness in English football by 2024.
BryanClefe
Michael Jordan https://chicago-bulls.michael-jordan-ar.com is one of the greatest basketball players of all time, whose career with the Chicago Bulls is legendary.
StevenExank
современные спальни дизайн интерьера https://dizayn-interera-doma.ru
Jameslab
where can i buy generic clomid pills: can i purchase cheap clomid – where can i buy clomid for sale
Cazrozn
Привет, друзья!
Мы готовы предложить документы ВУЗов, расположенных в любом регионе России. Можно заказать качественно напечатанный диплом за любой год, включая документы СССР. Дипломы и аттестаты печатаются на “правильной” бумаге высшего качества. Это дает возможность делать государственные дипломы, которые не отличить от оригиналов. Документы заверяются всеми необходимыми печатями и штампами.
viracore.one/read-blog/116
Lazralx
Привет!
Мы предлагаем дипломы психологов, юристов, экономистов и других профессий по приятным тарифам.
mjcs-ikma.com/2024/06/30/купить-диплом-казахстан/
Herbertnop
Muhammad Ali https://american-boxer.muhammad-ali-ar.com is perhaps one of the most famous and greatest athletes in the history of boxing.
Keithglige
Mike Tyson https://american-boxer.mike-tyson-ar.com one of the most famous and influential boxers in history, was born on June 30, 1966 in Brooklyn, New York.
JeffreyThity
Manny Pacquiao https://filipino-boxer.manny-pacquiao-ar.com is one of the most prominent boxers in the history of the sport.
ThomasErert
https://clomiddelivery.pro/# buy generic clomid
Diplomi_rlkr
Здравствуйте!
Купить документ ВУЗа можно у нас.
diplomyx.com/kupit-diplom-kandidata-nauk
Dnrtcma
Добрый день!
Купить документ о получении высшего образования можно у нас в Москве.
diplomyx24.ru/kupit-diplom-rostov-na-donu
Успешной учебы!
Sazrfor
Привет!
Процесс получения диплома стоматолога: реально ли это сделать быстро?
obshenie.flybb.ru/viewtopic.php?f=2&t=687
Всегда вам поможем!
ThomasErert
http://doxycyclinedelivery.pro/# how can i get doxycycline
Jameslab
paxlovid india: paxlovid pill – paxlovid generic
GeorgeFrown
The golf https://arabic.golfclub-ar.com industry in the Arab world is growing rapidly, attracting players from all over the world.
Donaldrap
The road to the Premier League https://english-championship.premier-league-ar.com begins long before a team gets promoted to the English Premier League for the first time
Davidrer
The Italian football championship https://italian-championship.serie-a-ar.com known as Serie A, has seen an impressive revival in recent years.
Bretttes
In the German football https://german-championship.bundesliga-football-ar.com championship known as the Bundesliga, rivalries between clubs have always been intense.
RobertBleli
In recent years, the leading positions in the Spanish https://spanish-championship.laliga-ar.com championship have been firmly occupied by two major giants – Barcelona and Real Madrid.
Eanrbnb
Привет Мы изготавливаем дипломы любой профессии по приятным ценам. blitzguard.mk/купить-диплом-среднее-образование-эт/
Lazrfjf
Добрый день!
Мы предлагаем дипломы любой профессии по невысоким ценам.
http://www.greenmind.cl/2024/06/30/диплом-магистра-1997-2003-видео/
RobertGoole
The Saudi Football League https://saudi-arabian-championship.saudi-pro-league-ar.com known as the Saudi Professional League, is one of the most competitive and dynamic leagues in the world.
Kennethchoky
https://euroavia24.com – Cheap flights, hotels and transfers around the world!
IsaiasBut
Rodrigo Goes https://real-madrid.rodrygo-ar.com better known as Rodrigo, is one of the brightest young talents in modern football.
Oscarvib
Arsenal https://arsenal.mesut-ozil-ar.com made a high-profile signing in 2013, signing star midfielder Mesut Ozil from Real Madrid.
ThomasErert
http://paxloviddelivery.pro/# п»їpaxlovid
Uazrrif
Привет, друзья!
Приобрести диплом ВУЗа.
lucylink.com/read-blog/53
Mazrfuf
Здравствуйте!
Как приобрести диплом о среднем образовании в Москве и других городах
sportraketka.ru/vash-diplom-kachestvo-i-autentichnost
DavidRerse
Thibaut Courtois https://real-madrid.thibaut-courtois-ar.com was born on May 11, 1992 in Belgium.
Trefebg
Привет, друзья!
Приобретение школьного аттестата с официальным упрощенным обучением в Москве
dom-nam.ru/index.php/forum/stroitelnye-kompanii/50337-kupit-diplom#81222
Будем рады вам помочь!.
VictorLoawl
Bayern Munich’s https://bayern.jamal-musiala-ar.com young midfielder, Jamal Musiala, has become one of the brightest talents in European football.
Dnrtgkb
Здравствуйте!
Приобрести документ о получении высшего образования можно у нас.
diploms-x.com/kupit-diplom-ekaterinbur
Удачи!
Larrymon
подъемник мачтовый грузовой строительный пмг грузовые подъемники спб
Jameslab
order generic clomid without insurance: buy generic clomid no prescription – can i purchase cheap clomid prices
ThomasErert
http://amoxildelivery.pro/# amoxicillin tablets in india
Brianswolo
Al-Nasr https://saudi.al-nassr-ar.com is one of the most famous football teams in the Kingdom of Saudi Arabia.
MichaelBal
Al-Ittihad https://saudi.al-ittihad-ar.com is one of the most famous football clubs in Saudi Arabia. Founded in 1927, the Saudi football giant has come a long way to the pinnacle of success.
Sazruxq
Привет, друзья!
Узнайте стоимость диплома высшего и среднего образования и процесс получения
bestnasos.ru/forum/user/4197
Рады оказаться полезными!
JosephcoF
Al-Nasr Club https://saudi.al-hilal-ar.com from Riyadh has a rich history of success, but its growth has been particularly impressive in recent years.
Diplomi_takr
Привет, друзья!
Заказать документ о получении высшего образования вы можете у нас.
diplomyx.com/kupit-diplom-specialista
Keithfam
FC Barcelona https://spain.fc-barcelona-ar.com is undoubtedly one of the most famous and well-known football clubs in the world.
Diplomi_oast
где купить диплом московская область diploms-x.com .
Igibkm
purchase noroxin generic – buy confido pills for sale generic confido
ThomasErert
http://paxloviddelivery.pro/# paxlovid generic
Danrbcs
Добрый день Мы изготавливаем дипломы любой профессии. http://www.zainduz.eus/eu/купила-диплом-а-он-скачан/ Будем рады вам помочь.
Dnrtnuo
Привет!
Заказать документ института вы имеете возможность в нашей компании в Москве.
ast-diplom24.ru/kupit-diplom-krasnoyarsk
Успехов в учебе!
Yrefcpl
Привет!
Заказать диплом любого университета.
galantclub.od.ua/member.php?u=15983
Удачи!
CarrollPsype
rent a boat herceg novi https://boat-hire-in-montenegro.com
MichaelNus
FC Bayern Munich (Munich) https://germany.bayern-munchen-ar.com is one of the most famous and recognized football clubs in Germany and Europe
RandallNIC
Arsenal https://england.arsenal-ar.com is one of the most famous and successful football clubs in the history of English football.
TimothyDinia
Real Madrid’s https://spain.real-madrid-ar.com history goes back more than a century. The club was founded in 1902 by a group of football enthusiasts led by Juan Padilla
Uazrwhi
Привет, друзья!
Где заказать диплом специалиста?
messenger.wepluz.com/read-blog/11105
Lariorrcc
Пошаговая инструкция по официальной покупке диплома о высшем образовании
ast-diplom24.ru/otzyvy
StevenMef
Thai Company Directory https://thaicorporates.com List of companies and business information.
CharlesLiaks
Ремонт плоской кровли https://remontiruem-krovly.ru в Москве, цена работы за 1 м?. Прайс лист на работы под ключ, отзывы и фото.
Michaelsef
AC Milan https://italy.milan-ar.com is one of the most successful and decorated football clubs in the world.
Manrieq
Привет, друзья!
Заказать документ института
ast-diplomy.com/kupit-diplom-krasnoyarsk
Xazrvvf
Добрый день!
Полезная информация как официально купить диплом о высшем образовании
arusak-diploms-srednee.ru/diplom-sredne-spetcialnoe-obrazovanie В
Lazrmmb
Привет!
Мы изготавливаем дипломы любой профессии по приятным тарифам.
dailygram.com/blog/1300025/купите-дипломы-быстро-и-надежно/
JamesVal
Galatasaray https://turkey.galatasaray-ar.com is one of the most famous football clubs in Turkiye, with a glorious and eventful history.
Michaelirrab
The fascinating story of Ja Morant’s https://spain.atletico-madrid-ar.com meteoric rise, from status from rookie to leader of the Memphis Grizzlies and rising NBA superstar.
GeorgeChelf
In the world of football, Atletico Madrid https://spain.atletico-madrid-ar.com has long been considered the second most important club in Spain after the dominant, Real Madrid.
DavidCom
The future football star Shabab Al-Ahly https://dubai.shabab-al-ahli-ar.com was born in Dubai in 2000. From a young age, he showed exceptional football abilities and joined the youth academy of one of the UAE’s leading clubs, Shabab Al-Ahly.
Jameslab
doxycycline cost australia: buy doxycycline 100mg online india – can i buy doxycycline in india
TerryJaire
квартиры с отделкой от застройщика купить 1 квартиру застройщика
Timothyhoaft
купить квартиру от застройщика купить новостройку с ремонтом
GregoryLow
Indibet is a premier online casino offering a wide array of games including slots, table games, and live dealer options. Renowned for its user-friendly interface and robust security measures, Indibet ensures a top-notch gaming experience with exciting bonuses and 24/7 customer support.
RobertSit
купить двухкомнатную в новостройке купить новую квартиру застройщик
Diplomi_hakr
Добрый день!
Приобрести документ о получении высшего образования вы сможете у нас.
ast-diplom.com/kupit-diplom-tehnikuma-kolledzha
Dnrtosd
Привет, друзья!
Заказать документ университета вы сможете в нашей компании в Москве.
diploms-x.com/kupit-diplom-vracha
Удачи!
Treftei
Привет, друзья!
Реально ли приобрести диплом стоматолога? Основные этапы
kungur.hldns.ru/forum/profile.php?action=show&member=9614
Рады оказать помощь!.
Lazrsyc
Привет!
Мы предлагаем дипломы любой профессии по доступным тарифам.
dachkanews.ru/kupite-diplom-dlya-vashego-budushhego/
JamesClula
недвижимость новостройки купить https://novye-kvartiryspb.ru
ThomasSorce
недорогие квартиры от застройщика купить 3 комнатную квартиру
WilliamhiC
купить 2 квартиру новостройке https://newkvartiry-spb.ru
Matthewabews
новостройки купить цены https://novyekvartiry2.ru
Allenjuddy
купить 1 комнатную квартиру купить 1 комнатную квартиру в новостройке
DanielHab
купить двухкомнатную квартиру в новостройке https://zastroyshikekb.ru
WilliamIrrip
купить двухкомнатную квартиру квартиры с отделкой от застройщика
Tommiesep
купить новую квартиру застройщик https://kvartira-novostroi.ru
RaymondAdace
купить двухкомнатную в новостройке купить квартиру от застройщика цены
Dnrtwqj
Привет, друзья!
Заказать документ института вы сможете в нашей компании в столице.
ast-diplom24.ru/kupit-diplom-ekaterinbur
Успехов в учебе!
ThomasNoF
Помощь в решении задач https://zadachireshaem-online.ru. Опытные авторы с профессиональной подготовкой окажут консультацию в решении задач на заказ недорого, быстро, качественно
RogerDriny
купить квартиру от застройщика с отделкой купить новостройку от застройщика
Johnnytob
Заказать контрольную работу https://kontrolnye-reshim.ru, недорого, цены. Решение контрольных работ на заказ срочно.
DavidDal
Заказать дипломную работу https://diplomzakazat-oline.ru недорого. Дипломные работы на заказ с гарантией.
Charlesvom
Заказать курсовую работу https://kursovye-napishem.ru в Москве: цены на написание и выполнение, недорого
Arthurnog
Accessibility Team Meeting Notes https://make.wordpress.org/accessibility/2021/06/11/accessibility-team-meeting-notes-june-11-2021
Richarddon
Красивая музыка https://melodia.space для души слушать онлайн.
Diplomi_xjkr
Привет!
Купить документ ВУЗа вы сможете у нас в столице.
ast-diplom.com/kupit-diplom-s-registraciej
Danielscase
создание сайтов seo https://seoraskrutka43.ru
StevenDuh
seo казань https://seo-raskrutka43.ru
Dnrtxvr
Привет, друзья!
Приобрести документ о получении высшего образования можно в нашем сервисе.
ast-diplom.com/kupit-diplom-krasnoyarsk
Хорошей учебы!
Williamdab
продвижение сайт сколько стоит сео продвижение сайта в месяц
Brandontak
seo компании продвижение сайта сео
JamesMak
Останні новини України https://gromrady.org.ua сьогодні онлайн – головні події світу
HarryDat
Новинний ресурс https://actualnews.kyiv.ua про всі важливі події в Україні та світі.
RobertGuete
Новини сьогодні https://gau.org.ua останні новини України та світу онлайн
Lazrtyq
Добрый день!
Заказать диплом университета.
textualheritage.org/index.php?option=com_content&task=view&id=1067
EddieMib
Новини України https://kiev-online.com.ua останні події в Україні та світі сьогодні, новини України за минулий день онлайн
StephenZotte
Популярные репортажи https://infotolium.com в больших фотографиях, новости, события в мире
KennethObjew
Україна свіжі новини https://kiev-pravda.kiev.ua останні події на сьогодні
DavidTaive
Свіжі новини України https://lenta.kyiv.ua останні новини з-за кордону, новини політики, економіки, спорту, культури.
JoshuaAvaby
Україна останні новини https://lentanews.kyiv.ua головні новини та останні події
Lazrgch
Привет!
Мы предлагаем дипломы любой профессии по выгодным тарифам.
http://www.globalcorp.it/купить-диплом-мгудт-или-любого-вуза-ро/
Uazrsob
Привет!
Где заказать диплом специалиста?
http://www.marqueze.net/miembros/matthewmorgan/profile/classic/
Richardabame
Головні новини https://pto-kyiv.com.ua України та світу
Jeromesom
Головні новини https://mediashare.com.ua про регіон України. Будьте в курсі останніх новин
DerekUnres
Новини та аналітика https://newsportal.kyiv.ua ситуація в Україні.
Shawnsmono
Новини України https://sensus.org.ua та світу сьогодні. Головні та останні новини дня
Henryliz
Новини, останні події https://prp.org.ua в Україні та світі, новини політики, бізнесу та економіки, законодавства
KevinJeamy
Корисні та цікаві статті https://sevsovet.com.ua про здоров’я, дозвілля, кар’єру.
Daviddug
Головні новини https://status.net.ua сьогодні, найсвіжіші та останні новини України онлайн
Terrymat
Останні новини https://thingshistory.com зовнішньої та внутрішньої політики в країні та світі.
Danielwak
Останні новини світу https://uamc.com.ua про Україну від порталу новин Ukraine Today
Diplomi_mmkr
Привет!
Приобрести документ ВУЗа можно в нашей компании в столице.
diplomasx.com/kupit-diplom-kazan
Dnrtcfy
Привет!
Купить документ университета вы сможете в нашей компании в столице.
ast-diplomy24.ru/kupit-diplom-o-srednem-obrazovanii
Успехов в учебе!
Manrrli
Добрый день!
Приобрести документ о получении высшего образования
ast-diplomy.com/kupit-diplom-moskva
Xazriqy
Привет, друзья!
Официальная покупка школьного аттестата с упрощенным обучением в Москве
arusak-diploms-srednee.ru/kupit-diplom-v-cheliabinske В